Một hỗn hợp X gồm FeSO4 và Al2(SO4)3,trong đó số ngyên tử oxi trong X chiếm 20/29 tổng số nguyên tử trong các nguyên tố trong hỗn hợp X. Tính thành phàn % khỗi lượng mỗi chất trong hỗn hợp X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đặt tỉ lệ số phân tử Fe2(SO4)3 và MgSO4 là x,y
=> Số nguyên tử O: 12x + 4y
Tổng số nguyên tử: 17x +6y
Ta có:
\(\dfrac{12x+4y}{17x+6y}=\dfrac{32}{47}\Leftrightarrow47.\left(12x+4y\right)=32.\left(17x+6y\right)\\ \Leftrightarrow564x-544x=192y-188y\\ \Leftrightarrow20x=4y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{1}{5}\)
=> Phần trăm khối lượng mỗi chất trong hh:
\(\%mFe2\left(SO4\right)3=\dfrac{400.1}{400.1+120.5}.100=40\%\\ \%mMgSO4=100\%-40\%=60\%\)

Đáp án C
Gọi
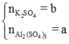
Áp dụng định luật bảo toàn nguyên tố cho O, Al, K và S ta có:
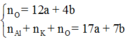
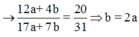
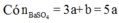
Nên
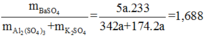
Đáp án C

Đáp án : D
Giả sử có 1 mol hỗn hợp gồm x mol Al2(SO4)3 và (1 – x) mol K2SO4
=> tổng số mol các nguyên tố
= nAl + nK + nS + nO = 2x + 2.(1 – x) + (3x + 1 – x) + 4.( 3x + 1 – x) = 10x + 7
=>nO = nngto.%nO
=> 4.(3x + 1 – x) = (10x + 7).20/31
=> x = 1/3 mol
=> mhh đầu = 230g
Khi phản ứng với BaCl2 thì nBaSO4 = nSO4 = 3x + 1 – x = 5/3 mol
=> mBaSO4 = 388,3g
=> mBaSO4 : mhh = 1,688 lần

Gọi số nguyên tử của \(Al_2(SO_4)_3\) và \(K_2SO_4\) lần lượt là x và y.
Số nguyên tử của \(Al_2(SO_4)_3\) là \(2+3+4\cdot3=17x\)
Số nguyên tử của \(K_2SO_4\) là \(2+1+4=7y\)
Mà số nguyên tử \(O_2\) trong hỗn hợp là \(4\cdot3x+4y=12x+4y\)
Theo bài: \(n_{O_2}=\dfrac{20}{31}n_{hh}\)
\(\Rightarrow12x+4y=\dfrac{20}{31}\left(17x+7y\right)\)
\(\Rightarrow y=2x\)
Có \(\%m_{Al_2\left(SO_4\right)_3}=\dfrac{342x}{342x+174y}\cdot100\%=\dfrac{342x}{342x+174\cdot2x}\cdot100\%=49,56\%\)
\(\%m_{K_2SO_4}=100\%-49,56\%=50,44\%\)
\(\%m_{\dfrac{O}{Nhôm.sunfat}}=\dfrac{4.16.3}{342}.100\approx56,14\%\\ \%m_{\dfrac{O}{Kali.sunfat}}=\dfrac{4.16}{174}.100\approx36,78\%\\ Gọi:a=n_{Al_2\left(SO_4\right)_3};b=n_{K_2SO_4}\left(a,b>0\right)\\ \Rightarrow Vì:m_{\dfrac{O}{hh}}=\dfrac{20}{31}\\ \Leftrightarrow\dfrac{a.12+b.4}{17a+7b}.100\%=\dfrac{20}{31}\\ \Leftrightarrow32a=16b\\ \Leftrightarrow\dfrac{a}{b}=\dfrac{16}{32}=\dfrac{1}{2}\\ \Leftrightarrow b=2a\\ \%m_{\dfrac{K_2SO_4}{hh}}=\dfrac{174.2a}{174.2a+342.a}.100\%\approx50,435\%\\ \Rightarrow\%m_{\dfrac{Al_2\left(SO_4\right)_3}{hh}}\approx49,565\%\)

Gọi: \(\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=x\left(mol\right)\\n_{CuSO_4}=y\left(mol\right)\end{matrix}\right.\) ⇒ mhh = 342x + 160y (g)
BTNT O, có: \(n_O=12n_{Al_2\left(SO_4\right)_3}+4n_{CuSO_4}=12x+4y\left(mol\right)\)
⇒ mO = 16.(12x+4y) = 192x + 64y (g)
Mà: O chiếm 48,34% khối lượng.
\(\Rightarrow\dfrac{192x+64y}{342x+160y}=0,4834\) \(\Rightarrow y=2x\)
\(\Rightarrow\%m_{Al_2\left(SO_4\right)_3}=\dfrac{342x}{342x+160y}.100\%=\dfrac{342x}{342x+160.2x}.100\%\approx51,66\%\)
\(\%m_{CuSO_4}\approx48,34\%\)

Gọi: \(\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=a\left(mol\right)\\n_{Na_2SO_4}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow m_X=342a+142b\left(g\right)\)
BTNT O, có: \(n_O=12n_{Al_2\left(SO_4\right)_3}+4n_{Na_2SO_4}=12a+4b\left(mol\right)\)
\(\Rightarrow m_O=16.\left(12a+4b\right)=192a+64b\left(g\right)\)
Mà: O chiếm 50% về khối lượng.
\(\Rightarrow\dfrac{192a+64b}{342a+142b}=0,5\) \(\Rightarrow b=3a\)
\(\Rightarrow\%m_{Al_2\left(SO_4\right)_3}=\dfrac{342a}{342a+142b}.100\%=\dfrac{342a}{342a+142.3a}.100\%=44,53125\%\)
\(\%m_{Na_2SO_4}=100-44,53125=55,46875\%\)

Đầu tiên anh không ngờ là e lại chịu khó cày đến như vậy. Anh sẽ hướng dẫn e làm bài này:
gọi số mol nhôm sunfat là x, kali sunfat là y
trong nhôm sunfat có 17 nguyên tử, trong đó có 12 nt oxi
trong kali sunfat có 7 nt, trong đó có 4 nt oxi
đến đây e lập tỷ lệ: ====>2x-y=0
sau đó e giả sử hỗn hợp ban đầu là 3 mol( e lấy bnhiu kug dc, a lấy 3 mol vì nó ra số chẵn), ta có thêm 1 pt nữa: x+y=3
Giải hệ này e dc : x=1: y=2
tỷ lệ em cần tìm là:
Gọi số mol FeSO4, Al2(SO4)3 là a, b (mol)
nFe = a (mol)
nAl = 2b (mol)
nS = a + 3b (mol)
nO = 4a + 12b (mol)
Có: \(\dfrac{n_O}{\Sigma n}=\dfrac{4a+12b}{a+2b+a+3b+4a+12b}=\dfrac{20}{29}\)
=> a = 2b
\(\left\{{}\begin{matrix}\%m_{FeSO_4}=\dfrac{152a}{152a+342b}.100\%=\dfrac{152.2b}{152.2b+342b}.100\%=47,059\%\\\%m_{Al_2\left(SO_4\right)_3}=100\%-47,059\%=52,941\%\end{matrix}\right.\)