đốt 16, 25g zn trong bình chưa 3.36 lít cl2 sau pu thu được hoàn toàn chất rắn x cho x vào dung dịch agno3 dư thì thu đc lượng kết tủa là
A 46,30g
B 57,10g
C 53,85g
D 64,65g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Zn + Cl_2 \xrightarrow{t^o} ZnCl_2\\ n_{Zn} = \dfrac{13}{65} = 0,2 > n_{Cl_2} = 0,15\). Do đó.Zn dư
Zn + Cl2 \(\xrightarrow{t^o}\) ZnCl2
0,15.......0,15....0,15......................(mol)
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
0,05........................................... 0,1..........(mol)
ZnCl2 + 2AgNO3 → 2AgCl + Zn(NO3)2
0,15...............................0,3.........................(mol)
Vậy :
\(m_{kết\ tủa} = 0,1.108 + 0,3.143,5 = 53,85(gam)\)
\(n_{Zn}=\dfrac{13}{65}=0.2\left(mol\right)\)
\(Zn+Cl_2\underrightarrow{t^0}ZnCl_2\)
\(0.15....0.15...0.15\)
\(\Rightarrow Zndư,Cl_2hết\)
\(ZnCl_2+2AgNO3\rightarrow Zn\left(NO_3\right)_2+2AgCl\)
\(0.15..................................................0.3\)
\(m_{AgCl}=0.3\cdot143.5=430.05\left(g\right)\)
Chúc bạn học tốt !!!

nHCl cần = 2nO trong oxit = 0,24 mol → nHCl đã dùng (dư 25%) = 0,3 mol.
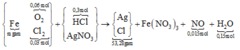
Ghép cụm có nH2O = nO trong oxit + 2nNO
→ nNO = 0,015 mol.
∑nCl = 0,36 mol đi hết vào 53,28 gam tủa
→ về nguyên tố nAg trong tủa = 0,375 mol
Bảo toàn N có nFe(NO3)3 = (0,375 – 0,015) ÷ 3 = 0,12 mol.
→ Yêu cầu m = mFe = 0,12 × 56 = 6,72 gam.
Đáp án A

Đáp án A
Ta có nHCl cần dùng = 2∑nO trong oxit = 0,24 mol → ∑nHCl đã dùng (dư 25%) = 0,3 mol.
* Gộp cả quá trình có sơ đồ:
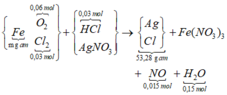
Ghép cụm NO3 bảo toàn O hoặc bảo toàn electron mở rộng ta có:
![]()
∑nCl = 0,36 mol đi hết vào 53,28 gam tủa → về mặt nguyên tố ∑nAg trong tủa = 0,375 mol.
→ Bảo toàn nguyên tố N có
![]()
Theo đó, m gam Fe ban đầu tương ứng với 0,12 mol → m = 0,12 × 56 = 6,72 gam.
\(n_{Zn}=\dfrac{16.25}{65}=0.25\left(mol\right)\)
\(n_{Cl_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(Zn+Cl_2\underrightarrow{^{t^0}}ZnCl_2\)
\(0.15...0.15.....0.15\)
\(Zn+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2Ag\)
\(0.25-0.15..................................0.2\)
\(ZnCl_2+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2AgCl\)
\(0.15..................................................0.3\)
\(m_{AgCl}=0.3\cdot143.5=43.05\left(g\right)\)
\(m_{Ag}=0.2\cdot108=21.6\left(g\right)\)
\(m\downarrow=43.05+21.6=64.65\left(\right)\)
=> D
Đừng chọn bừa đáp án như vậy nhé bạn !