Ngâm một thanh kim loại R có khối lượng 50g vào trong dung dịch HCl. Sau khi phản ứng kết thúc thu được 0.56 lít H2 (dktc) và thấy khối lượng kim loại giảm 3.25% so với ban đầu. Xác định tên kim loại R
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Gọi kim loại cần tìm là M
\(m_{M\left(pư\right)}=\dfrac{50.1,68}{100}=0,84\left(g\right)\)
\(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
PTHH: 2M + 2xHCl --> 2MClx + xH2
\(\dfrac{0,03}{x}\) <--------------------0,015
=> \(M_M=\dfrac{0,84}{\dfrac{0,03}{x}}=28x\left(g/mol\right)\)
Xét x = 1 => L
Xét x = 2 => MM = 56(Fe)
b) Mình nghĩ đề thiếu dữ kiện :v

a) \(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
Gọi kim loại cần tìm là A, có hoá trị x (x:nguyên, dương)
\(2A+2xHCl\rightarrow2ACl_x+xH_2\uparrow\\ m_{giảm}=m_{kim.loại}=1,68\%.50=0,84\left(g\right)\\ n_A=\dfrac{0,015.2}{x}=\dfrac{0,03}{x}\left(mol\right)\\ \Rightarrow M_A=\dfrac{0,84}{\dfrac{0,03}{x}}=28x\left(\dfrac{g}{mol}\right)\)
Xét: x=1;x=2;x=3;x=8/3 => Nhận x=2 khi đó MA=56(g/mol)
=> A là Sắt (Fe=56)
b) Không tính được nồng độ dd muối vì không có khối lượng dung dịch HCl

Câu 1:
2M+nCuSO4\(\rightarrow\)M2(SO4)n+nCu
2M+nFeSO4\(\rightarrow\)M2(SO4)n+nFe
- Gọi a là số mol của M
- Độ tăng khối lượng PTHH1:
64na/2-Ma=20 hay(32n-M).a=20
- Độ tăng khối lượng PTHH2:
56.na/2-Ma=16 hay (28n-M)a=16
Lập tỉ số ta được:\(\dfrac{32n-M}{28n-M}=\dfrac{20}{16}=1,25\)
32n-M=35n-1,25M hay 0,25M=3n hay M=12n
n=1\(\rightarrow\)M=12(loại)
n=2\(\rightarrow\)M=24(Mg)
n=3\(\rightarrow\)M=36(loại)
Câu 2:Gọi A là khối lượng thanh R ban đầu.
R+Cu(NO3)2\(\rightarrow\)R(NO3)2+Cu
R+Pb(NO3)2\(\rightarrow\)R(NO3)2+Pb
- Gọi số mol Cu(NO3)2 và Pb(NO3)2 là x mol
- Độ giảm thanh 1: \(\dfrac{\left(R-64\right)x}{A}.100=0,2\)
- Độ tăng thanh 2: \(\dfrac{\left(207-R\right)x}{A}.100=28,4\)
Lập tỉ số: \(\dfrac{207-R}{R-64}=\dfrac{28,4}{0,2}=142\)
207-R=142R-9088 hay 143R=9295 suy ra R=65(Zn)
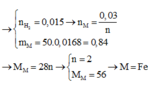
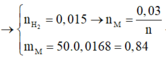
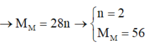


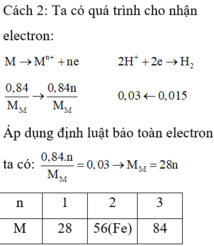

\(m_{giảm} =m_{R\ pư}= 50.3,25\% = 1,625(gam) \\ \text{Gọi n là hóa trị của kim loại R}\\ 2R + 2nHCl \to 2RCl_n + nH_2\\ n_{H_2} = \dfrac{0,56}{22,4} = 0,025(mol) \Rightarrow n_R = \dfrac{2}{n}n_{H_2} = \dfrac{0,05}{n}(mol)\\ \Rightarrow \dfrac{0,05}{n}.R = 1,625 \Rightarrow R = \dfrac{65}{2}n\)
Với n = 2 thì R = 65(Zn)
Vậy R là kim loại kẽm
R là kim loại kẽm