Để điều chế oxi trong phòng thí nghiệm người ta đun nóng 15,8 gam kali permanganat (KMnO4). Tính thể tích khí oxi thu được sau phản ứng?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 3.
a.b.\(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2mol\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,2 0,3 ( mol )
\(V_{O_2}=0,3.22,4=6,72l\)
c.\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,2 < 0,3 ( mol )
0,2 0,1 ( mol )
\(m_{Al_2O_3}=0,1.102=10,2g\)
Câu 4.
a.b.
\(n_{KClO_3}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,1 0,15 ( mol )
\(V_{O_2}=0,15.22,4=3,36l\)
c.\(n_{Fe}=\dfrac{8,4}{56}=0,15mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,15 < 0,15 ( mol )
0,15 0,05 ( mol )
\(m_{Fe_3O_4}=0,05.232=11,6g\)

\(n_{KClO_3\left(bd\right)}=\dfrac{55,125}{122,5}=0,45\left(mol\right)\)
=> \(n_{KClO_3\left(pư\right)}=\dfrac{0,45.85}{100}=0,3825\left(mol\right)\)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
0,3825------------------->0,57375
=> \(V_{O_2}=0,57375.22,4=12,852\left(l\right)\)

\(a,PTHH:2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\\ b,n_{KMnO_4}=\dfrac{15,8}{158}=0,1\left(mol\right)\\ n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ c,4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\ n_{P_2O_5}=\dfrac{2}{5}.n_{O_2}=\dfrac{2}{5}.0,05=0,02\left(mol\right)\\ m_{P_2O_5}=0,02.142=2,84\left(g\right)\)

a.\(n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1mol\)
\(3Fe+2O_2\rightarrow Fe_3O_4\)
0,3 0,2 0,1 ( mol )
\(m_{Fe}=0,3.56=16,8g\)
\(V_{O_2}=0,2.22,4=4,48l\)
b.\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,4 0,2 ( mol )
\(m_{KMnO_4}=\dfrac{0,4.158}{90\%}=70,22g\)
Em hãy chọn cặp từ thích hợp điền vào chỗ trống:
Em hãy tả một loài cây mà em thích nhất trong đó có sử dụng các biện pháp tu từ,so sánh đó).

a, \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
b, \(n_{KMnO_4}=\dfrac{47,4}{158}=0,3\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_P=0,15\left(mol\right)\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
c, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
Theo PT: \(n_P=\dfrac{4}{5}n_{O_2}=0,12\left(mol\right)\Rightarrow m_P=0,12.31=3,72\left(g\right)\)

-thu oxi có 2 loại
-Đẩy kk ; là ta lật ngửa bình để thu=>O2 nặng hơn kk
-Đẩy nước : ta có thể dời nước =>O2 ko tan trong nước , ko td vs nước
2
cùng 1 lượng oxi
2KMNO4-to>K2MnO4+MnO2+O2
2KClO3-to>2KClO3+3O2
=>\(\dfrac{a}{b}=\dfrac{2.158}{2\backslash3.122,5}=3.869\)
thu khí O2 bằng 2pp :
đẩy nước vì O2 ít tan trong nước
đẩy KK bằng cách đặt ngửa bình vì O2 nhẹ hơn KK
gọi nO2 là x
\(pthh:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
2x x
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(\dfrac{2}{3}x\) x
=> \(\left\{{}\begin{matrix}m_{KMnO_4}=2x.158=316x\\m_{KClO_3}=\dfrac{2}{3}x.122,5=81,6x\end{matrix}\right.\)
=> \(\dfrac{a}{b}=\dfrac{316x}{81,6x}=\dfrac{395}{102}\)

a) Phương trình hóa học của phản ứng:
3Fe + 2O2 → Fe3O4.
nFe3O4 = 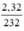 = 0,01 mol.
= 0,01 mol.
nFe = 3.nFe3O4 = 0,01 .3 = 0,03 mol.
nO2 = 2.nFe3O4 = 0,01 .2 = 0,02 mol.
mFe = 0,03.56 = 1,68g.
mO2 = 0,02.32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
nKMnO4 = 2.nO2 = 0,02.2 = 0,04 mol.
mKMnO4 = 0,04 .158 = 6,32g.

PTHH: 2KMnO4 → K2MnO4 + MnO2 + O2 ↑
Số mol của K2MnO4 là: 78,8 : 197 = 0,4 mol
Số mol của KMnO4 là: 142,2 : 158 = 0,9 mol
So sánh: \(\frac{0,9}{2}>0,4\)
=> KMnO4 chưa được nhiệt phân hết. Tính theo K2MnO4
a) Số mol của MnO2 là: 0,4 mol
Khối lượng MnO2 thu đc là: 0,4 . 87 = 34,8 (gam)
b) Số mol của O2 là: 0,4 mol
Thể tích O2 thu đc là: 0,4 . 22,4 = 8,96 lít
c) Khối lượng O2 thu đc là: 0,4 . 32 = 12,8 gam
pt: 2 KMnO4 ----to--> K2MnO4 + MnO2 + O2
2mol 1mol 1mol 1mol
0,9 mol 0,4 mol
nKMnO4 = 142,2 / 158 = 0,9 mol
nK2MnO4 = 78,8 / 197 = 0,4 mol
Tỉ lệ : \(\frac{0,9}{2}\) > \(\frac{0,4}{1}\)
Vậy n KMnO4 dư nên kê mol các chất còn lại theo n K2MnO4
pt: 2 KMnO4 -----to----> K2MnO4 + MnO2 + O2
2mol 1mol 1mol 1mol
0,8 mol 0,4mol 0,4mol 0,4mol
a) mMnO2= n.M 0,4 . 87 = 34,8 g
b) VO2= n . 22,4 = 0,4 . 22,4 = 8,96 lít
c) mO2 = n.M = 0,4 . 32 = 12,8 g
Chúc bạn học tốt !!!!
![]()

a.\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
2 2 3 ( mol )
0,1 0,15
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)
b.\(V_{kk}=V_{O_2}.5=3,36.5=16,8l\)
c.\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{28}{56}=0,5mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
3 2 1 ( mol )
0,5 > 0,15 ( mol )
0,225 0,15 ( mol )
\(m_{Fe\left(du\right)}=n_{Fe\left(du\right)}.M_{Fe}=\left(0,5-0,225\right).56=15,4g\)
2KMnO4-to>K2MnO4+MnO2+O2
0,1------------------------------------0,05
n KMnO4=\(\dfrac{15,8}{158}\)=0,1 mol
=>VO2=0,05.22,4=1,12l