Ngâm một lá đồng vào dd AgNO3 . Sau phản ứng khối lượng lá đồng tăng 0,76g. Tính số gam đồng tham gia vào phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Số mol AgNO3 = 0,03 (mol)
Phương trình phản ứng:

Ta có: 108.2a - 64a = 152a = 1,52 → a = 0,01 (mol)
Số mol AgNO3 còn lại = 0,03 -2.a = 0,03 - 2.0,01 = 0,01 mol
Nồng độ AgNO3 = 0,01/0,1 = 0,1M

Ag + AgNO3 (không phản ứng)
Cu + 2AgNO3 -> 2Ag +Cu(NO3)2
0.04 0.08
n(Ag)=8.8/108=0.08 mol
m(Cu)=0.04*64=2.56(g)
%m(Cu)=(2.56*100)/5=51.2%

Đáp án B
Khối lượng AgNO3 = 250.4/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
⇒ Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
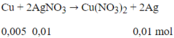
Khối lượng vật bằng Cu = 10 - 0,005.64 + 0,01.108 = 10,76 (g)

Đáp án B
Khối lượng AgNO3 = 250.4/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
⇒Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
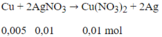
Khối lượng vật bằng Cu = 10 - 0,005.64 + 0,01.108 = 10,76 (g)

Cu+ 2AgNO3 -----> Cu(NO3)2+ 2Ag
a.......2a.........................a...............2a
a)Gọi a là số mol Cu p/ ư
Ta có ▲mtăng=mAg-mCu=108*2a-64a=1.52 g
<=>152a=1.52=>a=0.01 mol
=>CmANO3=2a/0.02=0.02/0.02=1M
b) Ta có mdd CuNO3=D*V=20*1.1=22 g
mCuNO3=126*a=126*0.01=1.26 g
=>C%CUNO3=1.26*100/22=5.72%

Gọi a là số mol của Zn phản ứng
Zn (a) + 2AgNO3 (2a) -----> Zn(NO3)2 + 2Ag (2a)
=> nAg(tạo) = 2a (mol)
mZn (pư) = 65a (gam)
mAg (tạo) = 216a (gam)
=> 216a - 65a =1,51
=> a = 0,01 (mol)
- Theo pthh: nAgNO3 = 2a = 0,02 (mol)
=> mAgNO3 = 170.0,02 = 3,4 gam
=> C%AgNO3 = (3,4.100)/42,5 = 8%
=> x = 8
Chọn A
Cu + 2Ag(NO3)2 => Cu(NO3)2 + 2Ag
x___________________________2x
m tăng = mAg - mCu = 108*2x - 64x = 0.76
=> x = 0.005 mol
mCu = 0.005*64 = 0.32 (g)