Cho 9 ml dung dịch AgNO3 2M vào 10 ml dung dịch NaX 1,5M; lọc kết tủa sau khi phản ứng kết thúc thì thu được 2,82 gam kết tủa. 1. Xác định nguyên tố halogen X. 2. Xác định số mol các chất còn lại trong dung dịch sau phản ứng.
giúp mik với ạ ![]()
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
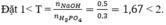
Vậy sau phản ứng thu được hai muối NaH 2 PO 4 (x mol) và Na 2 HPO 4 (y mol)
Bảo toàn P có: x + y = 0,3
Bảo toàn Na có: x + 2y = 0,5
Giải hệ phương trình được x = 0,1 và y = 0,2.
Vậy khối lượng hai muối NaH 2 PO 4 và Na 2 HPO 4 lần lượt là 12 gam và 28,4 gam.

Đáp án : D
nNaOH = 0,5 mol ; nH3PO4 = 0,3 mol
=> nH3PO4 < nNaOH < 2nH3PO4
Xảy ra các phản ứng :
NaOH + H3PO4 -> NaH2PO4 + H2O
x <- x -> x
2NaOH + H3PO4 -> Na2HPO4 + 2H2O
2y <- y -> y
=> x + 2y = 0,5 ; x + y = 0,3
=> x = 0,1 ; y = 0,2 mol
=> 12,0 gam NaH2PO4; 28,4 gam Na2HPO4.

\(\left\{{}\begin{matrix}n_{HCl}=0,1.2=0,2\left(mol\right)\\n_{NaOH}=0,2.1,5=0,3\left(mol\right)\end{matrix}\right.\)
PTHH: NaOH + HCl ---> NaCl + H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\Rightarrow\) NaOH dư
`=>` ddA làm QT đổi sang màu xanh

Chọn đáp án B
Ta có


Chú ý : Đầu tiên Fe2+ sẽ (sinh ra khí NO) trước sau đó còn dư mới tác dụng với Ag+
m=0,6.143,5+0,05.108=91,5(g)
\(n_{AgNO_3}=0,009.2=0,018\left(mol\right)\\ n_{NaX}=1,5.0,01=0,015\left(mol\right)\\ NaX+AgNO_3\rightarrow AgX\downarrow+NaNO_3\\ Vì:\dfrac{0,018}{1}>\dfrac{0,015}{1}\\ \Rightarrow AgNO_3dư\\ \Rightarrow n_{AgX}=n_{NaX}=0,015\left(mol\right)\\ \Rightarrow M_{AgX}=\dfrac{2,82}{0,015}=188\left(\dfrac{g}{mol}\right)=M_{Ag}+M_X=M_X+108\\ \Leftrightarrow M_X=80\left(\dfrac{g}{mol}\right)\\ \Rightarrow X:Brom\left(Br=80\right)\\ 2,dd.sau.phản.ứng:AgNO_3\left(dư\right),NaNO_3\\ n_{AgNO_3\left(p.ứ\right)}=n_{NaNO_3}=n_{NaBr}=0,015\left(mol\right)\\ \Rightarrow n_{AgNO_3\left(dư\right)}=0,018-0,015=0,003\left(mol\right)\)