Cho 4,8g Mg tác dụng với 6,72 lít khí O2 (đktc) . Sau phản ứng thu được Magie oxit MgO
a/ Chất nào còn dư sau phản ứng và dư bao nhiêu gam
b/ Tìm khối lượng sản phẩm thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PT: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
Ta có: \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{2}< \dfrac{0,25}{1}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{1}{2}n_{Mg}=0,1\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,25-0,1=0,15\left(mol\right)\)
Bạn tham khảo nhé!
PTHH: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
Ta có: \(\left\{{}\begin{matrix}n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\n_{O_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{2}< \dfrac{0,25}{1}\) \(\Rightarrow\) Magie p/ứ hết, Oxi còn dư
\(\Rightarrow n_{O_2\left(dư\right)}=0,25-0,1=0,15\left(mol\right)\)

Anh đoán là đkc chứ không phải đktc nhưng em cứ phản hồi nhé!

Bài 1:
a) nP=6,2/31=0,2(mol); nO2= 6,72/22,4=0,3(mol)
PTHH: 4P + 5 O2 -to-> 2 P2O5
Ta có: 0,2/4 < 0,3/5
=> P hết, O2 dư, tính theo nP
=> nO2(p.ứ)= 5/4. nP= 5/4. 0,2=0,25(mol)
=> mO2(dư)=0,3- 0,25=0,05(mol)
=> mO2(dư)=0,05.32=1,6(g)
b) nP2O5= nP/2= 0,2/2=0,1(mol)
=>mP2O5=0,1.142=14,2(g)

a)
\(n_{Mg} = \dfrac{4,8}{24} = 0,2(mol)\\ n_{O_2} = \dfrac{3,36}{22,4}= 0,15(mol)\\ 2Mg + O_2 \xrightarrow{t^o} 2MgO\)
Ta thấy :
\( \dfrac{n_{Mg}}{2} = 0,1 < n_{O_2} = 0,15 \) nên O2 dư.
\(n_{O_2\ pư} = \dfrac{n_{Mg}}{2} = 0,1(mol)\\ m_{O_2\ dư} = (0,15-0,1).32 = 1,6(gam)\\ V_{O_2\ dư} = (0,15-0,1).22,4 = 1,12(lít)\)
b)
\(n_{MgO} = n_{Mg} = 0,2\ mol\\ \Rightarrow m_{MgO} = 0,2.40 = 8\ gam\)

Câu 1 :
$n_C = \dfrac{4,8}{12} = 0,4(mol) ; n_{O_2} = \dfrac{7,437}{24,79} = 0,3(mol)$$
$C + O_2 \xrightarrow{t^o} CO_2$
Ta thấy :
$n_C : 1 > n_{O_2} : 1$ nên C dư
$n_{C\ pư} = n_{O_2} = 0,3(mol) \Rightarrow m_{C\ dư} = (0,4 - 0,3).12 = 1,2(gam)$
$\Rightarorw V_{CO_2} = V_{O_2} = 7,437(lít)$
Câu 2 :
$n_{Mg} = \dfrac{2,4}{24} = 0,1(mol)$
$n_{Cl_2} = \dfrac{9,916}{24,79} = 0,4(mol)$
$Mg + Cl_2 \xrightarrow{t^o} MgCl_2$
Ta thấy :
$n_{Mg} : 1 < n_{Cl_2} : 1$ nên $Cl_2$ dư
$n_{Cl_2\ pư} = n_{Mg} = 0,1(mol) \Rightarrow m_{Cl_2\ dư} = (0,4 - 0,1).71 = 21,3(gam)$
$n_{MgCl_2}= n_{Mg} = 0,1(mol) \Rightarrow m_{MgCl_2} = 0,1.95 = 9,5(gam)$

a, Theo gt ta có: $n_{H_2}=0,15(mol);n_{O_2}=0,05(mol)$
$2H_2+O_2\rightarrow 2H_2O$
Sau phản ứng $H_2$ còn dư. Và dư 0,05.22,4=1,12(l)
b, Ta có: $n_{H_2O}=2.n_{O_2}=0,1(mol)\Rightarrow m_{H_2O}=1,8(g)$

3Fe + 2O2 → Fe3O4
Theo pt : 3 2 1 mol
Theo đề bài : 0,2 0,3 0,2/3
a.
Ta có tỉ lệ \(\dfrac{0,2}{3}< \dfrac{0,3}{2}\) nên Fe phản ứng hết , oxi dư số mol sắt từ thu được tính theo Fe
b. nFe3O4 = 0,2/3 mol ==> m Fe3O4 = 0,2 /3 .232 = 15,47 gam

a, PTHH: S + O2 -> (t°) SO2
b, nS = 6,4/32 = 0,2 (mol)
nO2 = 6,72/22,4 = 0,3 (mol)
LTL: 0,2 < 0,3 => O2 dư
nO2 (pư) = nSO2 = nS = 0,2 (mol)
mO2 (dư) = (0,3 - 0,2) . 32 = 3,2 (g)
c, mSO2 = 64 . 0,2 = 12,8 (g)
a, \(S+O_2\underrightarrow{t^o}SO_2\)
\(nS=\dfrac{6,4}{32}=0,2\left(mol\right)\)
\(nO_2=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(\dfrac{0,2}{1}< \dfrac{0,3}{1}\) => oxi dư
\(nO_{2\left(dư\right)}=0,1\left(mol\right)\)
\(mO_{2\left(dư\right)}=0,1.32=3,2\left(g\right)\)
\(nSO_2=nS=0,2\left(mol\right)\)
\(mSO_2=0,2.64=12,8\left(g\right)\)

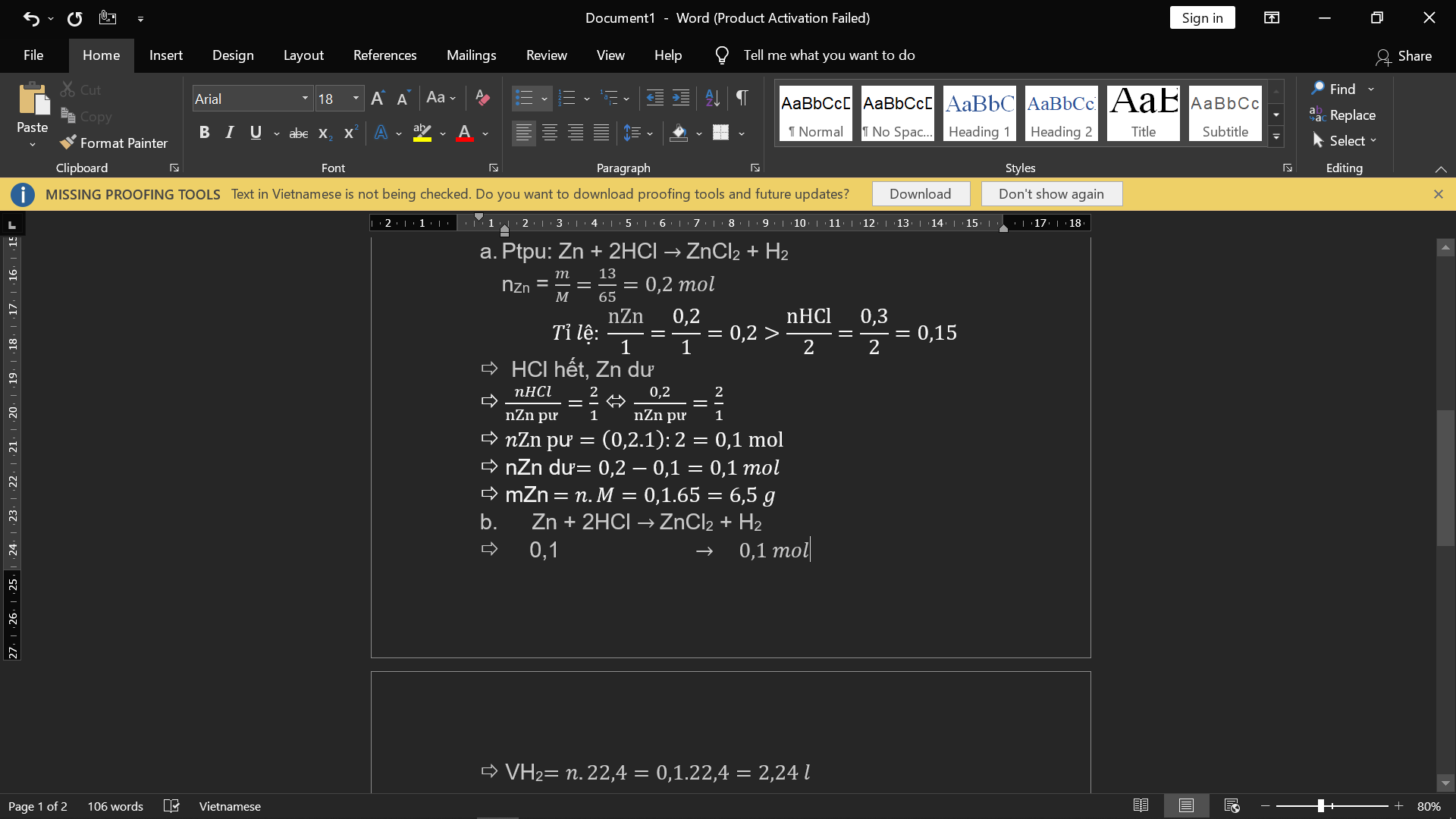
a. \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH : 2Mg + O2 -> 2MgO
0,2 0,1 0,2
Xét tỉ lệ : \(\dfrac{0,2}{2}< \dfrac{0,3}{1}\) => Mg đủ , O2 dư
\(m_{O_2\left(dư\right)}=\left(0,3-0,1\right).32=6,4\left(g\right)\)
b) \(m_{MgO}=0,2.40=8\left(g\right)\)