Hỗn hợp khí X gồm 2 hidrocacbon A và B là đồng đẳng kế tiếp nhau. Đốt cháy X với 64 gam O2 (dư) rồi dẫn sản phẩm qua bình đựng Ca(OH)2 dư thu được 100g chất tủa. Khí thoát ra khỏi bình có thể tích 11,2 lít ở 0 độ C và 0,4 atm. Xác định CTPT của A và B
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Từ giả thiết suy ra :
n C O 2 = n C a C O 3 = 100 100 = 1 m o l ; n O 2 p ư = n O 2 b đ - n O 2 d ư = 64 32 - 11 , 2 . 0 , 4 0 , 082 . 273 = 1 , 8 m o l .
Đặt công thức phân tử trung bình của A và B là C n ¯ H 2 n ¯ + 2
Phương trình phản ứng cháy:
C n ¯ H 2 n ¯ + 2 + 3 n ¯ + 1 2 O 2 → n ¯ C O 2 + ( n ¯ + 1 ) H 2 O ( 1 ) m o l x → 3 n ¯ + 1 2 . x → n ¯ . x
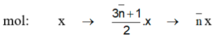


Vì A và B là hiđrocacbon nên khi đốt cháy chỉ thu được CO2 và H2O.
Ta có: \(n_{O_2}=\dfrac{64}{32}=2\left(mol\right)\)
\(n_{CO_2}=n_{CaCO_3}=\dfrac{100}{100}=1\left(mol\right)\)
Khí ra khỏi bình là O2 dư.
\(\Rightarrow n_{O_2\left(dư\right)}=\dfrac{pV}{RT}=\dfrac{0,4.11,2}{0,082.273}=0,2\left(mol\right)\)
BTNT O, có: \(n_{H_2O}=2n_{O_2}-2n_{O_2\left(dư\right)}-2n_{CO_2}=1,6\left(mol\right)\)
Có: nH2O > nCO2 nên A và b là ankan.
⇒ nankan = nH2O - nCO2 = 0,6 (mol)
Giả sử CTPT chung của A và B là: \(C_{\overline{n}}H_{2\overline{n}+2}\).
Có: n = số nguyên tử C = \(\dfrac{1}{0,6}=1,67\)
Mà: A và B là 2 ankan kế tiếp.
Nên A và B lần lượt là CH4 và C2H6.
Bạn tham khảo nhé!

a)
CH4 + 2O2 --to--> CO2 + 2H2O
C2H4 + 3O2 --to--> 2CO2 + 2H2O
b) Gọi số mol CH4, C2H4 là a, b (mol)
=> \(a+b=\dfrac{6,72}{22,4}=0,3\)
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
Khí thoát ra khỏi bình là CH4
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a---------------->a
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,2<------0,2
=> a = 0,2 (mol)
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,2}{0,3}.100\%=66,67\%\\\%V_{C_2H_4}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
c) b = 0,1 (mol)
CH4 + 2O2 --to--> CO2 + 2H2O
0,2--------------->0,2----->0,4
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,1----------------->0,2---->0,2
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,4------>0,4
=> \(m_{CaCO_3}=0,4.100=40\left(g\right)\)
\(\left\{{}\begin{matrix}m_{CO_2}=44\left(0,2+0,2\right)=17,6\left(g\right)\\m_{H_2O}=\left(0,4+0,2\right).18=10,8\left(g\right)\end{matrix}\right.\)
Xét \(\Delta m=m_{CO_2}+m_{H_2O}-m_{CaCO_3}=17,6+10,8-40=-11,6\left(g\right)\)
=> Khối lượng dd giảm 11,6 gam

\(n_{hhk}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
`->` Khí thoát ra là CH4
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,2 0,2 ( mol )
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
0,2 0,2 ( mol )
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
\(\%V_{CH_4}=\dfrac{0,2}{0,3}.100=66,67\%\)
\(\%V_{C_2H_4}=100-66,67=33,33\%\)

Đáp án C
Ta có mBình tăng = mCO2 + mH2O = 13,3 gam.
Với nCO2 = nBaCO3 = 0,2 mol ||⇒ nH2O = 0,25 mol.
Nhận thấy nC ÷ nH = 0,2 ÷ (0,25×2) = 2 ÷ 5


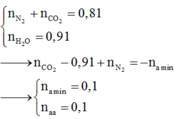
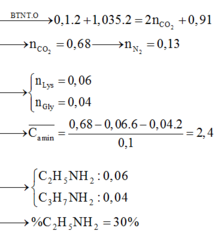
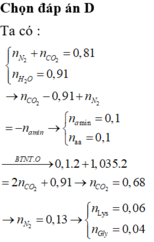
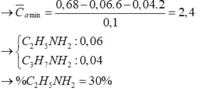
Ta có: \(n_{O_2\left(banđau\right)}=\dfrac{62}{32}=2\left(mol\right)\)
\(n_{CO_2}=n_{CaCO_3}=\dfrac{100}{100}=1\left(mol\right)\)
Khí thoát ra khỏi bình là O2 dư.
\(\Rightarrow n_{O_2\left(dư\right)}=\dfrac{pV}{RT}=\dfrac{0,4.11,2}{0,082.273}=0,2\left(mol\right)\)
\(\Rightarrow n_{O_2\left(pư\right)}=2-0,2=1,8\left(mol\right)\)
BTNT O, có: \(2n_{O_2\left(pư\right)}=2n_{CO_2}+n_{H_2O}\)
\(\Rightarrow n_{H_2O}=2.1,8-2.1=1,6\left(mol\right)\)
Vì đốt cháy 2 hiđrocacbon thu được nH2O > nCO2 nên A và B là ankan.
⇒ nankan = 1,6 - 1 = 0,6 (mol)
Gọi CTPT chung của A và B là \(C_{\overline{n}}H_{2\overline{n}+2}\)
\(\Rightarrow\overline{n}=\dfrac{1}{0,6}=1,667\)
Vậy: A và B là CH4 và C2H6.
Bạn tham khảo nhé!