Khi đốt 2,9g khí butan C 4 H 10 người ta thu được khí cacbonic và hơi nước.
A, Viết PTPƯ
B, Tính số gam nước tạo thành
C, Tính thể tích khí oxi đã dùng (đktc)
D, Nếu cũng dùng một thể tích khí oxi như trên để đốt sắt thì người ta sẽ thu đưọc bao
nhiêu gam oxit sắt từ (Fe 3 O 4 )
Hướng dẫn: Bài toán có 2 PTHH :
+ viết PTHH số 2
+ chất nào có ở cả 2 PT
+ dùng số mol của chất có ở cả 2 PT (đã tính đưuọc số mol từ PT1) để tính theo PTHH
số 2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) $C_2H_5OH + 3O_2 \xrightarrow{t^o} 2CO_2 + 3H_2O$
b) $n_{C_2H_5OH} = \dfrac{4,6}{46} = 0,1(mol)$
$n_{O_2} = 3n_{C_2H_5OH} = 0,3(mol)$
$V_{O_2} = 0,3.22,4 = 6,72(lít)$
c)
Theo PTHH :
$n_{CO_2} = 2n_{C_2H_5OH} = 0,2(mol) \Rightarrow V_{CO_2} = 0,2.22,4 = 4,48(lít)$
$n_{H_2O} = 3n_{C_2H_5OH} = 0,3(mol) \Rightarrow m_{H_2O} = 0,3.18 = 5,4(gam)$

Theo gt ta có: $n_{C_4H_{10}}=0,3(mol)$
$C_4H_{10}+\frac{13}{2}O_2\rightarrow 4CO_2+5H_2O$
Ta có: $n_{O_2}=1,95(mol)\Rightarrow V_{O_2}=43,68(l)$

a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
b, \(n_{CH_4}=\dfrac{28}{22,4}=1,25\left(mol\right)\)
\(n_{CO_2}=n_{CH_4}=1,25\left(mol\right)\Rightarrow m_{CO_2}=1,25.44=55\left(g\right)\)
c, \(n_{O_2}=2n_{CH_4}=2,5\left(mol\right)\Rightarrow V_{O_2}=2,5.22,4=56\left(l\right)\)

Mg+Cl2-to>MgCl2
0,25---0,25----0,25 mol
n Mg=6\24=0,25 mol
m MgCl2=0,25.95=23,75g
VCl2=0,25.22,4=5,6l

$a)PTHH:2Al+6HCl\to 2AlCl_3+3H_2$
$b)n_{Al}=\dfrac{5,4}{27}=0,2(mol)$
Theo PT: $n_{H_2}=1,5.n_{Al}=0,3(mol)$
$\Rightarrow V_{H_2}=0,3.22,4=6,72(lít)$
$c)$Theo PT: $n_{HCl}=3n_{Al}=0,6(mol)$
$\Rightarrow m_{HCl}=0,6.36,5=21,9(g)$
$d)PTHH:2H_2+O_2\xrightarrow{t^o}2H_2O$
Theo PT: $n_{H_2O}=n_{H_2}=0,3(mol)$
$\Rightarrow m_{H_2O}=0,3.18=5,4(g)$

\(n_{O_2}=\dfrac{1456:1000}{22,4}=0,065\left(mol\right)\\ a,2C_4H_{10}+13O_2\rightarrow\left(t^o\right)8CO_2+10H_2O\\ b,n_{CO_2}=\dfrac{8}{13}.0,065=0,04\left(mol\right)\\ n_{H_2O}=\dfrac{10}{13}.0,065=0,05\left(mol\right)\\ b,m_{sp}=m_{CO_2}+m_{H_2O}=44.0,04+18.0,05=2,66\left(g\right)\\ c,n_{C_4H_{10}}=\dfrac{2}{13}.0,065=0,01\left(mol\right)\\ V_{gas}=\dfrac{100}{80}.0,01.22,4=0,28\left(l\right)\)
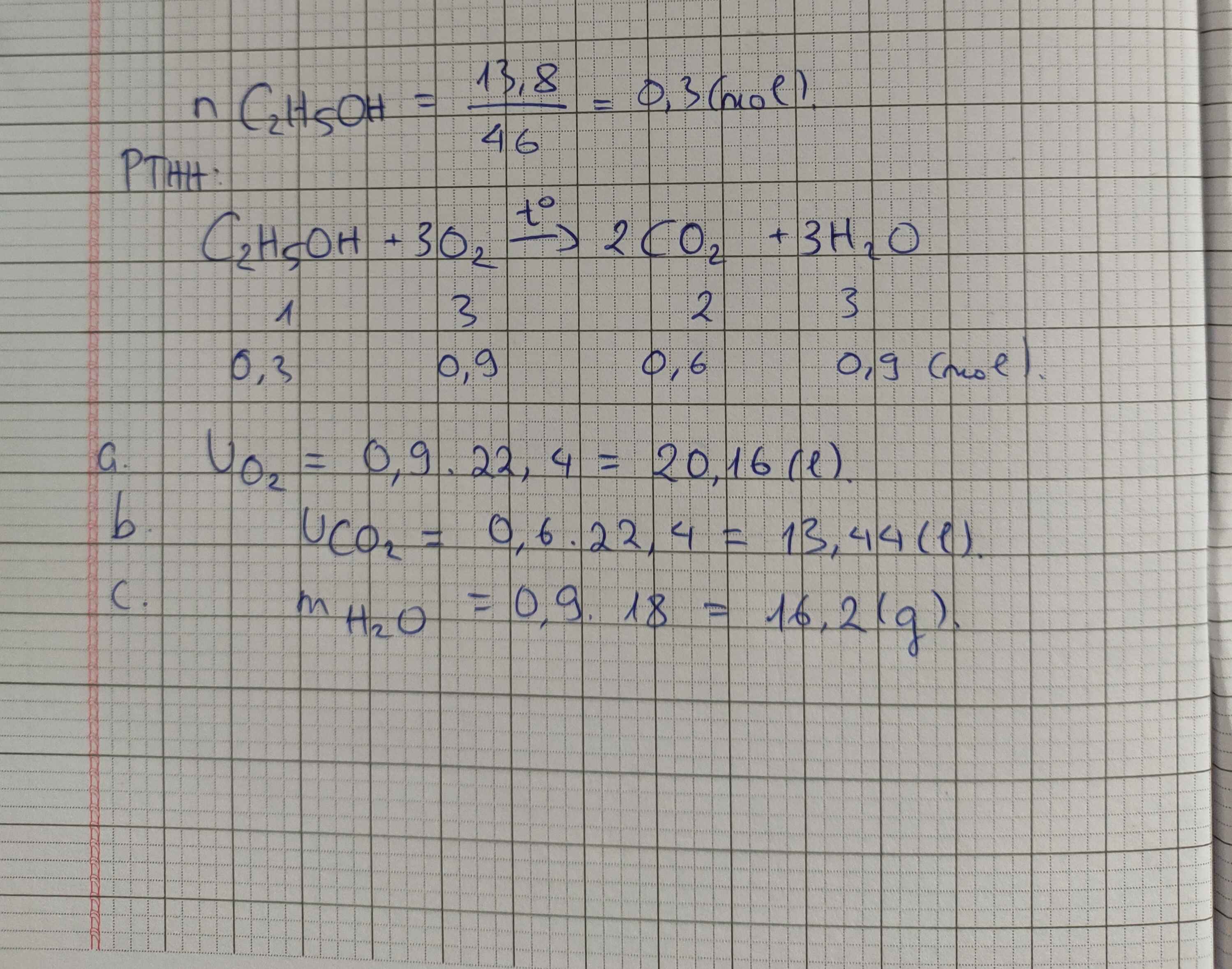
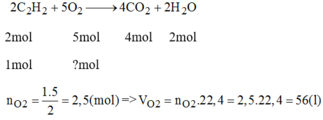

\(a,PTHH:2C_4H_{10}+13O_2\underrightarrow{t^o}8CO_2+10H_2O\\ b,n_{C_4H_{10}}=\dfrac{m}{M}=\dfrac{2,9}{58}=0,05\left(mol\right)\\ Theo.PTHH:n_{H_2O}=5.n_{C_4H_{10}}=5.0,05=0,25\left(mol\right)\\ m_{H_2O}=n.M=0,25.18=4,5\left(g\right)\)
\(c,Theo.PTHH:n_{O_2}=\dfrac{13}{2}.n_{C_4H_{10}}=\dfrac{13}{2}.0,05=0,325\left(mol\right)\\ V_{O_2\left(đktc\right)}=n.22,4=0,325.22,4=7,28\left(l\right)\\ d,PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\ Theo.PTHH:n_{Fe_3O_4}=\dfrac{1}{2}.n_{O_2}=\dfrac{1}{2}.0,325=0,1625\left(mol\right)\\ m_{Fe_3O_4}=n.M=0,1625.232=37,7\left(g\right)\)