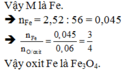Khử hoàn toàn 8 g một oxit kim loại thì cần dùng vừa đủ 3,36(l) CO. Đem toàn bộ lượng
kim loại thu được cho tác dụng với dung dịch HCl, sau phản ứng thu được 2,24 (l) H2. Tìm công thức và gọi tên oxit trên. Biết thể tích các chất khí đều đo ở đktc.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



\(n_{H_2thuđược}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
\(n_{H_2cầndùng}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Ta có : Số mol Oxi/Oxit = n H2 dùng = 0,6 ( mol )
\(m_{\dfrac{O}{Oxit}}=0,6.16=9,6\left(g\right)\)
\(m_{\dfrac{M}{Oxit}}=32-9,6=22,4\left(g\right)\)
Gọi hóa trị M là n
PTHH :
\(2M+2nHCl\rightarrow2MCl_2+nH_2\uparrow\)
\(\dfrac{2}{n}.0,4\) 0,4
\(M_M=\dfrac{22,4}{\dfrac{2}{n}.0,4}=28.n\)
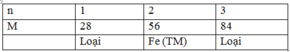
| n | 1 | 2 | 3 |
| M | 28 | 56 | 84 |
| Dk | (L) | T/M (Fe) | (L) |
Vậy kim loại M là Fe
\(\rightarrow\dfrac{n_{Fe}}{n_O}=\dfrac{\dfrac{22,4}{56}}{0,6}=\dfrac{2}{3}\)
Vậy CTPT của Oxit kim loại M là Fe2O3 .
Gọi hoá trị M là x nhưng mình làm lộn thành n , bạn đổi lại x thành n nha

a)
$Fe_2O_3 + 3CO \xrightarrow{t^o} 2Fe +3 CO_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$RO + H_2 \xrightarrow{t^o} R + H_2O$
b)
Coi m = 160(gam)$
Suy ra: $n_{Fe_2O_3} = 1(mol)$
Theo PTHH :
$n_{RO} = n_{H_2} = n_{Fe} = 2n_{Fe_2O_3} = 2(mol)$
$M_{RO} = R + 16 = \dfrac{160}{2} = 80 \Rightarrow R = 64(Cu)$
Vậy oxit là CuO

Ta có : + H2 --> H2O
0,06-----0,06
--> m(R) = 3,48 - 0,06.16 = 2,52 gam
--> \(\frac{2,25n}{M}=\frac{1,008}{22,4}\)(n là hoá trị của R)
--> 28.n = M
--> n = 2 --> M = 56 (Fe)
nFe : nO = 0,045 : 0,06 = 3 : 4 --> oxit là :

\(Đặt:CT:M_xO_y\)
\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(n_{Cl_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(M_xO_y+yH_2\underrightarrow{t^o}xM+yH_2O\)
\(n_{O\left(oxit\right)}=n_{H_2O}=n_{H_2}=0.15\left(mol\right)\)
\(\Rightarrow m_M=m_{oxit}-m_O=12-0.15\cdot16=9.6\left(g\right)\)
\(2M+nCl_2\underrightarrow{t^o}2MCl_n\)
\(\dfrac{0.3}{n}....0.15\)
\(M_M=\dfrac{9.6}{\dfrac{0.3}{n}}=32n\)
\(BL:\) \(n=2\Rightarrow M=64\)
\(CT:CuO\)

\(n_{H_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(n_{Fe}=n_{H_2}=0.2\left(mol\right)\)
\(m_{Cu}=m_{hh}-m_{Fe}=17.6-0.2\cdot56=6.4\left(g\right)\)
\(n_{Cu}=\dfrac{6.4}{64}=0.1\left(mol\right)\)
\(\Rightarrow m_{CuO}=0.1\cdot80=8\left(g\right)\)
\(m_{Fe_xO_y}=m_{hh}-m_{CuO}=24-8=16\left(g\right)\)
\(M_{Fe_xO_y}=\dfrac{16}{\dfrac{0.2}{x}}=80x\left(đvc\right)\)
\(\Leftrightarrow56x+16y=80x\)
\(\Leftrightarrow24x=16y\)
\(\Leftrightarrow\dfrac{x}{y}=\dfrac{16}{24}=\dfrac{2}{3}\)
\(CT:Fe_2O_3\)
\(Fe + 2HCl \to FeCl_2 + H_2\\ n_{Fe} = n_{H_2} = \dfrac{4,48}{22,4} = 0,2\ mol\\ \Rightarrow n_{Cu} = \dfrac{17,6-0,2.56}{64} = 0,1\ mol\)
BTNT với Fe,Cu
\(n_{CuO} = n_{Cu} = 0,1\ mol\\ n_{Fe_xO_y} = \dfrac{n_{Fe}}{x} = \dfrac{0,2}{x}mol\)
Suy ra ;
\(0,1.80 + \dfrac{0,2}{x}.(56x+16y) = 24\\ \Rightarrow \dfrac{x}{y} = \dfrac{2}{3}\)
Vậy oxit sắt cần tìm : Fe2O3