Cho m gam hỗn hợp gồm Mg và Zn hòa tan hoàn toàn trong dung dịch HCl loãng, vừa đủ thì thu được dung dịch X chứa 14,4 gam hỗn hợp muối clorua và 2,912 lít khí H2 (đktc) thoát ra. Xác định giá trị m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


n H 2 = 1,344/22,4 = 0,06
n H 2 SO 4 = n H 2 = 0,060
n SO 4 2 - = n H 2 SO 4 = 0,06
m muối = m kim loại + m SO 4 2 - = 3,22 + 0,06 x 96 = 8,98g

Đáp án B
Ta có mMuối = mKim loại + mSO42–.
Û mMuối = 3,22 + nH2 × 96 = 8,98 gam

Đáp án C
![]()
Bảo toàn khối lượng: 3,22 + 0,06.98 = m + 0,06.2
m = 8,98 gam

Ta có sơ đồ phản ứng:
m(gam) (Mg, Fe) + --O2→ (m+4,16) gam B + --HCl→ D (Mg2+ x mol; Fe2+ y mol; Fe3+ z mol); Cl-)
D + --AgNO3→ (11m – 12,58) gam (Ag + AgCl)
Ta có m(O) = 4,16 gam → n(O) = 0,26 mol → n(Cl- trong D) = 0,52 mol
→ n(AgCl) = 0,52 mol
Ta có hệ phương trình
(1): 24x + 56(y+z) = m
(2) ĐLBT điện tích: 2x+2y+ 3z = 0,52
(3) m + 0,52*35,5 = 4m-6,5
→ m = 8,32 gam → n(Ag) = 0,04 = y → x = 0,16; z = 0,04
Mặt khác trong 4,5m gam A có: Mg = 0,72 mol và Fe 0,36 mol
Dung dịch muối: Mg2+: 0,72 mol; Fe3+: 0,36mol; NH4+: t mol; NO3-: q mol
hợp khí F gồm N2 (0,04 mol) và N2O (0,04 mol)
Áp dụng ĐLBT mol e: → t = 0,225 mol
Áp dụng ĐLBT điện tích → q = 2,745 mol → m 211,68 gam → Đáp án C
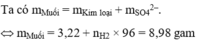

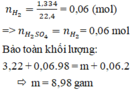
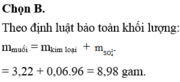
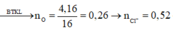
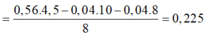
$Mg + 2HCl \to MgCl_2 + H_2$
$Zn + 2HCl \to ZnCl_2 + H_2$
$n_{H_2} = \dfrac{2,912}{22,4} = 0,13(mol)$
$n_{HCl} = 2n_{H_2} = 0,13.2 = 0,26(mol)$
Bảo toàn khối lượng :
$m = m_{muối} + m_{H_2} - m_{HCl} = 14,4 + 0,13.2 - 0,26.36,5 = 5,17(gam)$
em cảm ơn ạ