nêu hiện tượng và viết pthh của phản ứng xảy ra khi hỗn hợp rắn gồm NaOH và P2O5 có tỉ lệ mol 2:1 vào nước dư
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi \(n_{Cu}=3a\)
\(n_{Fe_3O_4}=a\)
\(\Rightarrow64.3a+232a=42,4\Rightarrow a=0,1mol\)
\(Fe_3O_4+8H^+\rightarrow2Fe^{3+}+Fe^{2+}+4H_2O\)
\(0,1\) \(0,2\) (mol)
\(Cu+2Fe^{3+}\rightarrow2Fe^{2+}+Cu^{2+}\)
\(0,1\)\(\leftarrow\) \(0,2\)
\(\Rightarrow n_{Cu}dư=0,3-0,1=0,2mol\)
\(\Rightarrow m=12,8g\)

Đáp án A
n H 2 = 8 , 96 22 , 4 = 0 , 4 mol
Gọi số mol Na là a mol => số mol của Al là 2a mol
m gam chất rắn không tan là Al => Al dư sau phản ứng với NaOH
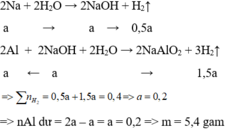

Gọi số mol Na và Al lần lượt là 2x và 4x (mol)
Khi cho hỗn hợp vào nước ta có thứ tự phản ứng:
2Na + 2H2O → 2NaOH + H2
2x ---------------------->2x x
Al + NaOH + H2O → NaAlO2 + 1,5H2
2x 2x 3x
=> ΣnH2 = x + 3x = 8,96:22,4 = 0,4
=> x = 0,1
=> nAl dư = 4x - 2x = 0,2 mol
<=> m CR không tan = mAl dư = 0,2.27 = 5,4 gam

Giải thích:
Gọi số mol của Na và Al lần lượt là x và 2x (mol)
Na + H2O → NaOH + 0,5H2
x x 0,5x
Al + NaOH + H2O → NaAlO2 + 1,5H2
x ← x → x → 1,5x
nH2 = 0,4 => 0,5x + 1,5x = 0,4 => x = 0,2
Chất rắn không tan là Al dư: nAl dư = 2x – x = x = 0,2 mol
=> m = mAl dư = 27.0,2 = 5,4 gam
Đáp án D


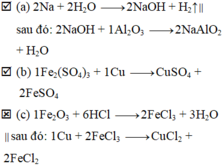
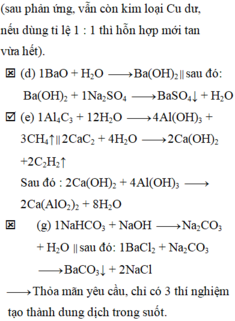
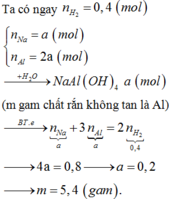
- Hiện tượng: hỗn hợp rắn tan
P2O5 + 3H2O --> 2H3PO4
NaOH + H3PO4 --> NaH2PO4 + H2O