Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\left\{{}\begin{matrix}n_{NaCl}=x\left(mol\right)\\n_{KCl}=y\left(mol\right)\end{matrix}\right.\)
\(n_{AgNO_3}=\dfrac{13,6}{170}=0,08mol\)
\(n_{AgCl\downarrow}=\dfrac{9,471}{143,5}=0,066mol\)
\(AgNO_3+NaCl\rightarrow AgCl\downarrow+NaNO_3\)
x x
\(AgNO_3+KCl\rightarrow AgCl\downarrow+KNO_3\)
y y
Mà \(\Sigma n_{AgCl}=x+y=0,066mol\)
\(\Sigma n_{AgNO_3}=x+y=0,08>\Sigma n_{AgCl}\)
\(\Rightarrow AgNO_3\) dư và dư 0,08-0,066=0,014mol

a)
$NaCl + AgNO_3 \to AgCl + NaNO_3$
$KCl + AgNO_3 \to AgCl + KNO_3$
$n_{AgNO_3} = \dfrac{13,6}{170} = 0,08 >n_{AgCl} = \dfrac{9,471}{143,5} = 0,066(mol)$
Do đó $AgNO_3$ dư.
$n_{NaCl } + n_{KCl} = n_{AgCl} = 0,066(mol)$
b)
$n_{AgNO_3\ pư} = n_{AgCl} = 0,066(mol)$
$n_{AgNO_3\ dư} = 0,08 - 0,066 = 0,014(mol)$
$Cu + 2AgNO_3 \to Cu(NO_3)_2 + 2Ag$
$n_{Ag} = n_{AgNO_3} = 0,066(mol)$
$n_{Cu} = \dfrac{1}{2}n_{AgNO_3} = 0,007(mol)$
$m_{Ag} - m_{Cu} = 0,014.108 -0,007.64 = 1,064(gam)$
Do đó, lá đồng tăng 1,064 gam

a) Dung dịch sau phản ứng tác dụng được với Cu
⇒\( AgN{O_3} \) dư, muối clorua phản ứng hết
Bảo toàn nguyên tố Cl:
\({n_{NaCl}} + {n_{KCl}} = {n_{AgCl}} = \dfrac{{9,471}}{{143,5}} = 0,066mol\)
b) \({n_{AgN{O_3}pu}} = {n_{AgCl}} = 0,066mol\)
\(\Rightarrow {n_{AgN{O_3}du}} = 0,08 - 0,066 = 0,014mol \)
\(Cu + 2AgN{O_3} \to Cu{(N{O_3})_2} + 2Ag\)
\({n_{Cupu}} = \dfrac{1}{2}{n_{AgN{O_3}du}} = 0,007mol \)
\(\Rightarrow {m_{Cu\tan g}} = {m_{Ag}} - {m_{Cupu}} = 0,014.108 - 0,007.64 = 1,064g \)

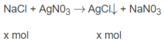
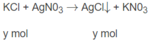
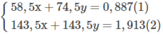
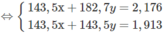
⇒ y = 6,71. 10 - 3 mol
Khối lượng KCl là : 74,5. 6,71. 10 - 3 = 0,5(g) KCl
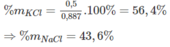

a)
Gọi $n_{NaCl} = a(mol) ; n_{KCl} = b(mol)$
$\Rightarrow 58,5a + 74,5b = 13,3(1)$
$NaCl + AgNO_3 \to AgCl + NaNO_3$
$KCl + AgNO_3 \to AgCl + KNO_3$
$n_{AgCl} = a + b = 10.\dfrac{2,87}{143,5} = 0,2(2)$
Từ (1)(2) suy ra a = b = 0,1
$m_{NaCl} = 0,1.58,5 = 5,85(gam)$
$m_{KCl} = 0,1.74,5 = 7,45(gam)$
b)
$C\%_{NaCl} = \dfrac{5,85}{500}.100\% = 1,17\%$
$C\%_{KCl} = \dfrac{7,45}{500}.100\% = 1,49\%$

Chúc bạn học tốt !!!
\(m_{hh}=74.5a+58.5b=26.6\left(g\right)\left(1\right)\)
\(n_{AgCl}=\dfrac{57.4}{143.5}=0.4\left(mol\right)\)
\(KCl+AgNO_3\rightarrow KNO_3+AgCl\)
\(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\)
\(n_{AgCl}=a+b=0.4\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):\)
\(a=b=0.2\)
\(m_{dd\left(saupư\right)}=26.6+500-57.4=469.2\left(g\right)\)
\(C\%_{KNO_3}=\dfrac{0.2\cdot101}{469.2}\cdot100\%=4.31\%\)
\(C\%_{NaNO_3}=\dfrac{0.2\cdot85}{469.2}\cdot100\%=3.62\%\)
