ngâm một lá sắt có khối lượng 2,5gam trong 25ml dung dịch CuSO4 15% có khố lượng riêng là 1,12g/ml.Sau một thời gian phản ứng,người ta lấy lá sắt ra khỏi dung dịch,rửa nhẹ,làm khô thì cân nặng 2,58(g)
a.Tính khối lượng đ CuSO4 trước phản và khối lượng CuSO4 còn dư
b.tính nồng độ phần trăm các chất trong dung dịch sau phản ứng
giúp với mai thi rồi ạ


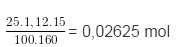

a) mdd CuSO4 = 25.1,12 = 28 (g)
=> \(m_{CuSO_4}=\dfrac{28.15}{100}=4,2\left(g\right)\)
PTHH: Fe + CuSO4 --> FeSO4 + Cu
_____a----->a---------->a--------->a
=> 2,5 + 64a - 56a = 2,58
=> a = 0,01 (mol)
=> mCuSO4 dư = 4,2 - 0,01.160 = 2,6 (g)
b) mdd sau pư = 28 + 0,01.56 - 0,01.64 = 27,92(g)
\(\left\{{}\begin{matrix}C\%\left(CuSO_4\right)=\dfrac{2,6}{27,92}.100\%=9,3\%\\C\%\left(FeSO_4\right)=\dfrac{0,01.152}{27,92}.100\%=5,44\%\end{matrix}\right.\)