Câu 8: Cho 13g Kẽm tác dụng với dung dịch axit Clohiđric thu được 27,2 g Kẽm Clorua và 0,4g khí Hiđro. Khối lượng axit tham gia phản ứng là:
A.14,2 g B. 7,3 g C. 14,6 g D. 14 g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Tỉ lệ số nguyên tử Kẽm : Số phân tử Axit Clohidric = 1:2
Tỉ lệ số nguyên tử Kẽm : Số phân tử Kẽm Clorua = 1:1
Tỉ lệ số nguyên tử kẽm ; Số phân tử khí Hidro = 1:1
Dạng này khá cơ bản, em coi không hiểu hỏi lại nhé!

Bài 4 câu a đề là thể tích H2 nha bạn
a)\(Fe2O3+3H2-->2Fe+3H2O\)
\(n_{Fe2O3}=\frac{12}{160}=0,075\left(mol\right)\)
\(n_{H2}=3n_{Fe2O3}=0,225\left(mol\right)\)
\(V_{H2}=0,225.22,4=5,04\left(l\right)\)
b)\(n_{Fe}=2n_{Fe2O3}=0,15\left(mol\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
Bài 6
a)\(Zn+H2SO4-->ZnSO4+H2\)
\(n_{Zn}=\frac{19,5}{65}=0,3\left(mol\right)\)
\(n_{ZnSO4}=n_{Zn}=0,3\left(mol\right)\)
\(m_{ZnSO4}=0,3.162=48,3\left(g\right)\)
b)\(n_{H2}=n_{Zn}=0,3\left(mol\right)\)
\(V_{H2}=0,3.22,4=6,72\left(l\right)\)

Zn + H2SO4 \(\)ZnSO4 + H2
0.2____________________0.2
ZnO + H2SO4\(\rightarrow\)ZnSO4 +H2O
nH2 =\(\frac{4,46}{22,4}\)=10.2 mol
\(\rightarrow\)mZn=0.2.65=13g
\(\rightarrow\)mZnO=32.5-13=19.5g

Câu 4:
PTHH: Zn + 2HCl ===> ZnCl2 + H2
Áp dụng định luật bảo toàn khối lượng, ta có:
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(\Leftrightarrow m_{HCl}=m_{ZnCl_2}+m_{H_2}-m_{Zn}\)
\(\Leftrightarrow m_{HCl}=27,2+0,4-13=14,6\left(gam\right)\)
Vậy khối lượng axit cần dùng là 14,6 gam

Đáp án B
Ta có:
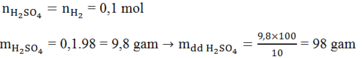
Áp dụng định luật bảo toàn khôi lượng:
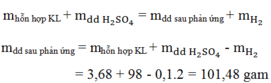
Theo ĐLBTKL: mZn + mHCl = mZnCl2 + mH2
=> mHCl = 27,2 + 0,4 - 13 = 14,6 (g)
C
Theo định luật bảo toàn khối lượng,
=> 13 + HCl = 27,1 + 0,4
=> HCl = 14,6