Khí A có thành phần phần trăm theo khối lượng là: 82,75% C và 17,25% H.
a/ Cho biết công thức hóa học của A?(Biết tỉ khối của khí A đối với khí oxi là
1,8125).
b/ Tính khối lượng của hợp chất A có chứa 2,88g C.
c/ Tính khối lượng của từng nguyên tố có trong 11,6 gam A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

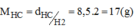
Khối lượng của nito trong 1 mol hợp chất:
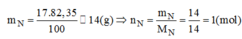
Khối lượng của hidro trong 1 mol hợp chất:
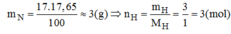
Vậy trong hợp chất có 1 mol nguyên tử N và 3 mol nguyên tử H.
→ Công thức hóa học đơn giản của hợp chất là N H 3

\(M_A=32\cdot2=64\left(g\text{/}mol\right)\)
CTHH của A là : SxOy
\(\%S=\dfrac{32x}{64}\cdot100\%=50\%\)
\(\Rightarrow x=1\)
\(M_A=32+16y=64\left(g\text{/}mol\right)\)
\(\Rightarrow y=2\)
CTHH của A là : SO2
MA=32⋅2=64(g/mol)
CTHH của A là : SxOy
%S=\(\dfrac{32x}{64}\)⋅100%=50%
⇒x=1
MA=32+16y=64(g/mol)
⇒y=2
CTHH của A là : SO2

b,
Ta có: dX/O2=1,375
=>Mx =1,375.32
=44(g/mol)
Ta lại có:
12.x/27,27=16.y/72,73=44/100
=>x=27,27.44/12.100=1
=> y=72,73.44/16.100=2
Vậy CTHH: CO2

a) Có 2R+(96x3)=342
Suy ra: R=27 là nhôm(Al)
b) MB=32x0,5=16
Suy ra: MA=16x2,125=34
Ta có : HuSv
5,88%=100u/34 =>u=2
94,12%=32 x 100 x v/34 => v=1
Vậy công thức hoá học của A là: H2S
Chúc bạn học tốt!

Câu a) dễ bạn tự làm được đúng không mình làm mẫu một câu nha
Theo bài ra , ta có :
\(M_{NaNO_3}=23+\left(14+16\times3\right)=85\)(g/mol)
Trong 1 mol NaNO3 có 1 mol nt Na, 1mol nt N , 3 mol nt O
Thành phần % của các nguyên tử có trong hợp chất NaNO3 là :
\(\%Na=\left(\frac{1\times23}{85}\right)\times100\%\approx27\%\)
\(\%N=\left(\frac{1\times14}{85}\right)\times100\%\approx16,5\%\)
\(\%O=100\%-\left(\%Na+\%N\right)=100\%\left(27+16,5\right)=56,5\%\)
Vậy .....
b) Gọi CTDC là : NxHy
Theo bài ra , ta có :
dhợp chất X/H2= \(\frac{M_{N_xH_y}}{M_{H_2}}=8,5\Rightarrow M_{N_xH_y}=8,5\times M_{H_2}=8,5\times2=17\)(g/mol)
Khối lượng của nguyên tố trong hợp chất là :
\(m_N=\frac{MN_xH_y}{100\%}\times\%N=\frac{17\times82,35\%}{100\%}\approx14\left(g\right)\)
\(m_H=\frac{MN_xH_y}{100\%}\times\%H=\frac{17\times17,65\%}{100\%}\approx3\left(g\right)\)
Số mol của mỗi nt trong 1 mol Hợp chất NxHy là :
\(n_N=\frac{m}{M}=\frac{14}{14}=1\left(mol\right)\)
\(n_H=\frac{m}{M}=\frac{3}{1}=3\left(mol\right)\)
Suy ra trong 1 mol phân tử NxHy có : 1 nguyên tử N , 3 nguyên tử H
Vậy CTHH là : NH3
Chúc bạn học tốt =))![]()

câu 4
MX= 8,5.2 = 17
gọi công thức NxHy
=> x:y = \(\frac{82,35}{14}:\frac{17,65}{1}=1:3\)
=> NH3
\(a,M_A=1,8125.32=58(g/mol)\)
Trong 1 mol A: \(\begin{cases} n_C=\dfrac{58.82,75\%}{12}=4(mol)\\ n_H=\dfrac{58-4.12}{1}=10(mol) \end{cases}\)
\(\Rightarrow CTHH_A:C_4H_{10}\\ b,n_C=\dfrac{2,88}{12}=0,24(mol)\\ \Rightarrow n_A=\dfrac{1}{4}n_C=0,06(mol)\\ \Rightarrow m_A=0,06.58=3,48(g)\\ c,n_A=\dfrac{11,6}{58}=0,2(mol)\\ \Rightarrow \begin{cases} n_C=0,2.4=0,8(mol)\\ n_H=0,2.10=2(mol) \end{cases}\Rightarrow \begin{cases} m_C=0,8.12=9,6(g)\\ m_H=2.1=2(g) \end{cases}\)