Hòa tan hết 15,2 gam Fe, Cu bằng dung dịch H,SO, đặc nóng sau phản ứng thu được dung dịch X. Cho X tác dụng với NaOH dư thu được kết tủa Y. Nung Y ngoài không khí đến khối lượng không đổi thu được 20,8 gam hỗn hợp Fe,O,, CuO. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Hòa tan bằng H2SO4 => Cu không tác dụng
Cho tác dụng NaOH dư chỉ còn lại kết tủa của Fe
Nung hidoxit của Fe trong không khí => thu được Fe2O3 => Đap an D

Đáp án C

- Giả sử Mg, Fe đều phản ứng hết với muối kim loại => Z chứa toàn bộ số mol Mg2+ ; Fex+
=> T chứa Mg(OH)2 và Fe(OH)x => Chất rắn cuối cùng là MgO và Fe2O3 chắc chắn phải có khối lượng lớn hơn lượng kim loại ban đầu trong X => Không thỏa mãn đề bài (7,2 < 7,36)
=> Các muối nitrat phản ứng hết, kim loại dư và đó là Fe (vì Mg phản ứng trước)
=> kết tủa Y gồm Cu, Ag, Fe.
- Gọi nMg = a ; nFe(pứ) = b ; nFe dư = c => mX = 24a + 56b + 56c = 7,36 (1)
- Bảo toàn e cho phản ứng trao đổi muối: 2nMg + 2nFe pứ = nAg + 2nCu = 2a + 2b
- Khi Y + H2SO4 đặc nóng (Fe → Fe3+)
Bảo toàn electron: 2nCu + nAg + 3nFe dư = 2nSO2 = 2.5,04/22,4 = 0,45 mol
=> 2a + 2b + 3c = 0,45 (2)
- Như đã phân tích ở trên. chất rắn cuối cùng gồm MgO và Fe2O3.
Bảo toàn nguyên tố: nMg = nMgO = a ; nFe2O3 = ½ nFe pứ = 0,5b
=> mrắn = mMgO + mFe2O3 = 40a + 160.0,5b = 40a + 80b = 7,2 (3)
Từ (1,2,3) => a = 0,12 ; b = 0,03 ; c = 0,05 mol
=> mFe(X) = 56.(0,03 + 0,05) = 4,48g
=> %mFe(X) = 4,48: 7,36 = 60,87%

Đáp án C
Có mhỗn hợp rắn < mFe => Chứng tỏ X chưa tan hết.
=> Fe bị oxi hóa lên Fe(II)
Đặt số mol Fe phản ứng và Fe dư lần lượt là x, y.
24 . n Mg + 56 . m Fe = 7 , 36 g → BTe 2 . n Mg + 2 x + 3 y = 2 . n SO 2 = 2 . 5 , 04 22 , 4 = 0 , 45 mol m MgO + m Fe 2 O 3 = 40 . n Mg + 160 . x 2 = 7 , 2 g ⇒ n Mg = 0 , 12 mol x = 0 , 03 y = 0 , 05
⇒ % m Fe ( X ) = 56 . ( x + y ) 7 , 36 . 100 % = 60 , 87 %

Đáp án : A
Ta thấy mX > mRắn (gồm oxit) => Y gồm cả Fe , Cu , Ag
Gọi số mol Mg là x ; số mol Fe phản ứng đầu là y và dư sau đó là z mol
=> mX = 24x + 56y + 56z = 7,36g (1)
Bảo toàn e : 2nMg + 2nFe pứ + 3nFe dư = nAg + 2nCu + 3nFe dư = 2nSO2
=> 2x + 2y + 3z = 0,45 mol
,mrắn = mMgO + mFe2O3 = 40x + 80y = 7,2g
=> x = 0,12 mol ; y = 0,03 mol ; z = 0,05 mol
=> %mFe(X) = 60,87%

Đáp án A
Có mhỗn hợp rắn =7,2 g < m X
=> Chứng tỏ X chưa phản ứng hết
Trường hợp 1: Mg còn dư, Fe chưa phản ứng
Đặt số mol Mg phản ứng là a, số mol Mg dư là b, số mol Fe là c.
⇒ 24 . ( a + b ) + 56 c = 7 , 36 g → BTe 2 ( a + b ) + 3 c = 2 n SO 2 = 2 . 5 , 04 22 , 4 = 0 , 45 mol m MgO = 40 a = 7 , 2 g ⇒ a = 0 , 18 b = - 0 , 102 c = 0 , 098
=> Loại
Trường hợp 2: Mg phản ứng hết, Fe còn dư
Đặt số mol Fe phản ứng chuyển thành Fe2+ là a, số mol Fe dư là b, số mol Mg là c.
⇒ 56 . ( a + b ) + 24 c = 7 , 36 g → BTe 2 ( c + a ) + 3 b = 2 n SO 2 = 2 . 5 , 04 22 , 4 = 0 , 45 mol m Fe 2 O 3 + m MgO = 160 . a 2 + 40 c = 7 , 2 g ⇒ a = 0 , 03 b = 0 , 05 c = 0 , 12
⇒ % m Fe = 56 . ( 0 , 03 + 0 , 05 ) 7 , 36 . 100 % = 60 , 87 %

Đáp án : C
nSO2 = 0,225 mol
Chất rắn sau khi nung chỉ nặng 7,2 gam nên toàn bộ Mg và Fe không thể chuyển hết về oxit được (Lúc đó mrắn > 7,36), tức là trong Y phải có Fe dư —> AgNO3 và Cu(NO3)2 đã hết
Đặt a, b, c là số mol Mg, Fe phản ứng và Fe dư —> 24a + 56(b + c) = 7,36
Chất rắn Y gồm Ag, Cu và Fe dư, phần Ag, Cu do Mg (a) và Fe (b) đẩy ra nên 2a + 2b = nAg + 2nCu
Trong khi đó: nAg + 2nCu + 3nFe dư = 2nSO2 —> 2a + 2b + 3c = 0,225.2
Chất rắn cuối bài gồm MgO (a) và Fe2O3 (b/2) —> 40a + 160b/2 = 7,2
Giải hệ: a = 0,12 mol b = 0,03 mol c = 0,05 mol —> nFe = 0,08 mol —> %mFe = 60,87%

Đáp án B
Ta nhận thấy mE < mX => KL chưa phản ứng hết; AgNO3 và Cu(NO3)2 hết
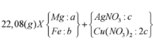
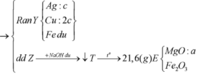
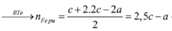
![]()
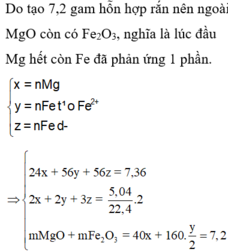
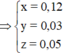
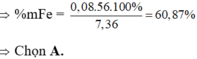

\(2Fe+6H_2SO_4\to Fe_2(SO_4)_3+3SO_2\uparrow+6H_2O\\ Cu+2H_2SO_4\xrightarrow{t^o}CuSO_4+SO_2\uparrow+2H_2O\\ Fe_2(SO_4)_3+6NaOH\to 2Fe(OH)_3\downarrow+3Na_2SO_4\\ CuSO_4+2NaOH\to Cu(OH)_2\downarrow+Na_2SO_4\\ 2Fe(OH)_3\xrightarrow{t^o}Fe_2O_3+3H_2O\\ Cu(OH)_2\xrightarrow{t^o}CuO+H_2O\)
Đặt \(n_{Cu}=x(mol);n_{Fe}=y(mol)\Rightarrow 64x+56y=15,2(1)\)
Theo các PT: \(n_{Fe_2O_3}=0,5y(mol);n_{CuO}=x(mol)\)
\(\Rightarrow 80x+80y=20,8(2)\\ (1)(2)\Rightarrow x=0,08(mol);y=0,18(mol)\\ \Rightarrow \%_{Cu}=\dfrac{0,08.64}{15,2}.100\%=33,68\%\\ \Rightarrow \%_{Fe}=100\%-33,68\%=66,32\%\)