Ngâm thỏi sắt vào 200 gam dung dịch CuSO4 8% cho đến khi sắt không tan được nữa. Tính a/_Khối lượng sắt phản ứng và khối lượng đồng sinh ra b/ Nồng độ % muối trong dung dịch sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{ZnSO_4}=\dfrac{241,5.10}{100}=24,15\left(g\right)=>n_{ZnSO_4}=\dfrac{24,15}{161}=0,15\left(mol\right)\)
PTHH: 2Al + 3ZnSO4 --> Al2(SO4)3 + 3Zn
_____0,1<----0,15-------->0,05----->0,15
=> mAl = 0,1.27 = 2,7(g)
=> mZn = 0,15.65=9,75(g)
b) mdd sau pư = 2,7 + 241,5 - 9,75 = 234,45(g)
=> \(C\%\left(Al_2\left(SO_4\right)_3\right)=\dfrac{0,05.342}{234,45}.100\%=7,294\%\)

a) Khi ngâm lá sắt vào dung dịch X thì không thấy khí thoát ra nên Cuo và H2SO4 phản ứng vừa đủ với nhau .
\(CuO+H_{2^{ }_{ }}SO_{4_{ }}\rightarrow CuSO_{4_{ }}+H_2O\left(1\right)\)
Khi dung dịch X không còn màu xanh thì CuSO4 đã phản ứng hết
\(CuSO_4+Fe\rightarrow FeSO_{4_{ }}+Cu\left(2\right)\)
Theo phản ứng (1) và (2)
\(n_{Cuo}=n_{H_2SO_4}=n_{CuSO_4}=n_{Cu}=\frac{2}{64-56}=0,25\left(mol\right)\)
Nồng độ phần trăm của dung dịch H2SO4
\(C\%_{H_2SO_4}=\frac{0,25.98}{122,5}.100\%=20\%\Rightarrow C=20\)
b) Khối lượng của dung dịch sau phản ứng:
\(m_{dd}=m_{CuO}+m_{ddH_2SO_4}-\left(m_{Cu}-m_{Fe}\right)=20+122,5-2=140,5\left(g\right)\)
Theo phản ứng (2) :
\(n_{FeSO_4}=n_{Cu}=0,25\left(mol\right)\Rightarrow m_{FeSO_4}=0,25.152=38\left(g\right)\)
Nồng độ phần trăm của dung dịch sau khi lấy sắt ra là:
\(C\%_{FeSO_4}=\frac{38}{140,5}.100\%=27,05\%\)

nCuSO4=0.2(mol)
Fe+CuSO4->FeSO4+Cu
0.2 0.2 0.2
mFe tan ra=0.2*56=11.2(g)
m chất rắn bám vào=0.2*64=12.8(g)
CMFeSO4=0.2:0.2=1(M)

Bài 10 :
\(m_{ct}=\dfrac{20.360}{100}=72\left(g\right)\)
\(n_{CuSO4}=\dfrac{72}{160}=0,45\left(mol\right)\)
Pt : \(Fe+CuSO_4\rightarrow FeSO_4+Cu|\)
1 1 1 1
0,45 0,45 0,45 0,45
a) \(n_{Fe}=\dfrac{0,45.1}{1}=0,45\left(mol\right)\)
⇒ \(m_{Fe}=0,45.56=25,2\left(g\right)\)
b) \(n_{FeSO4}=\dfrac{0,45.1}{1}=0,45\left(mol\right)\)
⇒ \(m_{FeSO4}=0,45.152=68,4\left(g\right)\)
\(m_{ddspu}=25,2+360-\left(0,45.64\right)=356,4\left(g\right)\)
\(C_{FeSO4}=\dfrac{68,4.100}{356,4}=19,19\)0/0
Chúc bạn học tốt

\(n_{AgNO_3}=0,2.3=0,6\left(mol\right)\)
\(n_{AgNO_3\left(pư\right)}=\dfrac{0,6.20}{100}=0,12\left(mol\right)\)
PTHH: 2AgNO3 + Fe --> Fe(NO3)2 + 2Ag
_______a------>0,5a---->0,5a
Fe(NO3)2 + AgNO3 --> Fe(NO3)3 + Ag
_0,5a------->0,5a------->0,5a
=> a + 0,5a = 0,12
=> a = 0,08(mol)
=> mFe = 0,5.0,08.56 = 2,24(g)
b) \(\left\{{}\begin{matrix}C_{M\left(AgNO_3\right)}=\dfrac{0,6-0,12}{0,2}=2,4M\\C_{M\left(Fe\left(NO_3\right)_3\right)}=\dfrac{0,5.0,08}{0,2}=0,2M\end{matrix}\right.\)

a)
$Fe + CuSO_4 \to FeSO_4 + Cu$
b) Theo PTHH :
n Fe = n Cu = n FeSO4 = n CuSO4 = 200.16%/160 = 0,2(mol)
m Fe = 0,2.56 = 11,2(gam)
c) m Cu = 0,2.64 = 12,8(gam)
d) m dd = 11,2 + 200 -12,8 = 198,4(gam)
m FeSO4 = 0,2.152 = 30,4(gam)
C% FeSO4 = 30,4/198,4 .100% = 15,32%
Ta có: mCuSO4 = 200.16% = 32 (g)
\(\Rightarrow n_{CuSO_4}=\dfrac{32}{160}=0,2\left(mol\right)\)
a, PT: \(Fe+CuSO_4\rightarrow FeSO_4+Cu_{\downarrow}\)
_____0,2____0,2______0,2_____0,2 (mol)
b, mFe = 0,2.56 = 11,2 (g)
c, mCu = 0,2.64 = 12,8 (g)
d, Ta có: m dd sau pư = mFe + m dd CuSO4 - mCu = 11,2 + 200 - 12,8 = 198,4 (g)
\(\Rightarrow C\%_{FeSO_4}=\dfrac{0,2.152}{198,4}.100\%\approx15,32\%\)
Bạn tham khảo nhé!

a) $Fe + CuSO_4 \to FeSO_4 + Cu$
b)
Khối lượng thanh sắt tăng là $13,2 - 10 = 3,2(gam)$
Theo PTHH : $n_{Cu} = n_{Fe\ pư} = a(mol)$
$\Rightarrow 64a - 56a = 3,2$
$\Rightarrow a = 0,4(mol)$
$m_{Fe} = 0,4.56 = 22,4(gam)$
$m_{Cu} = 0,4.64 = 25,6(gam)$
$c) n_{CuSO_4} = n_{Fe} = 0,4(mol)$
$\Rightarrow C_{M_{CuSO_4}} = \dfrac{0,4}{0,2} = 2M$
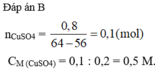

\(n_{CuSO_4}=\dfrac{200.8}{100.160}=0,1(mol)\\ PTHH:Fe+CuSO_4\to FeSO_4+Cu\\ a,n_{Cu}=n_{Fe}=n_{CuSO_4}=0,1(mol)\\ \Rightarrow m_{Cu}=0,1.64=6,4(g);m_{Fe}=0,1.56=5,6(g)\\ b,n_{FeSO_4}=0,1(mol)\\ \Rightarrow C\%_{FeSO_4}=\dfrac{0,1.152}{5,6+200-6,4}.100\%=7,63\%\)