Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(m_{CuSO_4}=40.10\%=4\left(g\right)\Rightarrow n_{CuSO_4}=\dfrac{4}{160}=0,025\left(mol\right)\)
PT: \(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
Theo PT: \(n_{Zn}=n_{ZnSO_4}=n_{Cu}=n_{CuSO_4}=0,025\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,025.65=1,625\left(g\right)\)
Ta có: m dd sau pư = 1,625 + 40 - 0,025.64 = 40,025 (g)
\(\Rightarrow C\%_{ZnSO_4}=\dfrac{0,025.161}{40,025}.100\%\approx10,056\%\)

\(m_{ZnSO_4}=\dfrac{241,5.10}{100}=24,15\left(g\right)=>n_{ZnSO_4}=\dfrac{24,15}{161}=0,15\left(mol\right)\)
PTHH: 2Al + 3ZnSO4 --> Al2(SO4)3 + 3Zn
_____0,1<----0,15-------->0,05----->0,15
=> mAl = 0,1.27 = 2,7(g)
=> mZn = 0,15.65=9,75(g)
b) mdd sau pư = 2,7 + 241,5 - 9,75 = 234,45(g)
=> \(C\%\left(Al_2\left(SO_4\right)_3\right)=\dfrac{0,05.342}{234,45}.100\%=7,294\%\)

Sau phản ứng, thu được hỗn hợp kim loại, suy ra kẽm dư.
$n_{CuSO_4} = \dfrac{80.30\%}{160} = 0,15(mol)$
$Zn + CuSO_4 \to ZnSO_4 + Cu$
$n_{Zn\ pư} = n_{CuSO_4} = 0,15(mol)$
$\Rightarrow m_{Zn\ pư} = 0,15.65 = 9,75(gam)$
Sau phản ứng, $m_{dd} = 9,75 + 80 - 0,15.64 = 80,15(gam)$
$C\%_{ZnSO_4} = \dfrac{0,15.161}{80,15}.100\% = 30,13\%$

a)
$Zn + CuSO_4 \to ZnSO_4 + Cu$
b)
Theo PTHH : $n_{Zn} = n_{CuSO_4} = \dfrac{3,2.10\%}{160} = 0,002(mol)$
$m_{Zn} = 0,002.65 = 0,13(gam)$
c)
$n_{Cu} = 0,002(mol)$
$\Rightarrow m_{dd\ sau\ pư} = 0,13 + 3,2 - 0,002.64 = 3,202(gam)$
$C\%_{ZnSO_4} = \dfrac{0,002.161}{3,202}.100\% = 10,06\%$

nCuSO4 = \(\dfrac{20.10\%}{160}\) = 0,0125 (mol)
Zn + CuSO4 \(\rightarrow\) ZnSO4 + Cu
0,0125 \(\leftarrow\) 0,0125 \(\rightarrow\) 0,0125 \(\rightarrow\) 0,0125 (mol)
mZn pư = 0,0125 . 65= 0,8125 (g)
mdd spư = 20 + 0,8125 - 0,0125.64 = 20,0125 (g)
C%(ZnSO4) = \(\dfrac{0,0125.161}{20,0125}\) . 100%= 10,06%

\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\\ a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ 0,05.........0,1..........0,05..........0,05\left(mol\right)\\ a.C\%_{ddHCl}=\dfrac{0,1.36,5}{200}.100=1,825\%\\ b.m_{Zn}=0,05.65=3,25\left(g\right)\\ c.C\%_{ddZnCl_2}=\dfrac{136.0,05}{3,25+200-0,05.2}.100\approx3,347\%\)

\(n_{CuSO_4}=\dfrac{200.8}{100.160}=0,1(mol)\\ PTHH:Fe+CuSO_4\to FeSO_4+Cu\\ a,n_{Cu}=n_{Fe}=n_{CuSO_4}=0,1(mol)\\ \Rightarrow m_{Cu}=0,1.64=6,4(g);m_{Fe}=0,1.56=5,6(g)\\ b,n_{FeSO_4}=0,1(mol)\\ \Rightarrow C\%_{FeSO_4}=\dfrac{0,1.152}{5,6+200-6,4}.100\%=7,63\%\)

Ta có: nCuSO4 = \(\dfrac{40\cdot10\%}{160}=0,025mol\)
PTHH: Zn + CuSO4 ➝ ZnSO4 + Cu
Mol:....0,025....0,025.......0,025.....0,025
=> mZn pứ = 0,025*65 = 1,625 g
Do CuSO4 phản ứng hết nên dung dịch sau phản ứng chỉ chứa chất tan là ZnSO4. Khối lượng mZnSO4 = 0,025 * 161 = 4,025g
Khối lượng dung dịch sau phản ứng:
mddsau = mddCuSO4 + mZn - mCu = 40 + 1,625 - 0,025*64 = 40,025 g
\(C\%_{ZnSO4}=\dfrac{m_{ZnSO4}}{m_{ddsau}}.100=\dfrac{4,025}{40,025}.100=10,06\%\)
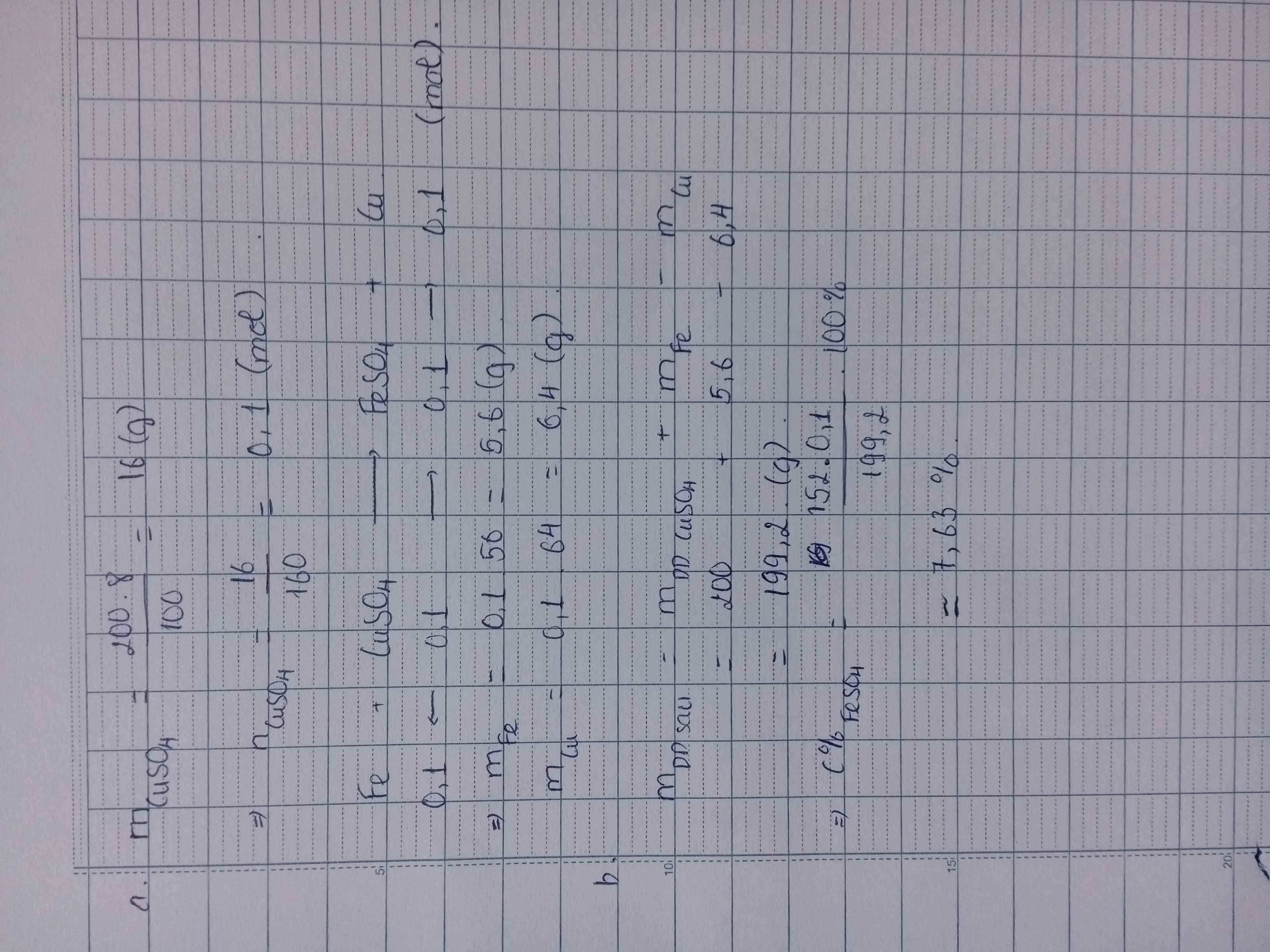
PTHH : \(Zn+CuSO_4\rightarrow ZnSO_4+Cu_{\downarrow}\)