Tìm CTHH của một hợp chất có chứa 36,8% Fe, 21% S, còn lại là Oxi, biết khối lượng mol của hợp chất là 152g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Sửa đề:bài 1: Hãy tìm CTHH của một hợp chất có chứa 36,8% Fe;21% S và còn lại là O . Biết khối lượng mol của hợp chất là 152 g/mol
Gọi CTHH của HC là FexSyOz
x=\(\dfrac{152.36,8\%}{56}=1\)
y=\(\dfrac{152.16,5\%}{32}=1\)
z=\(\dfrac{152-56-32}{16}=4\)
Vậy CTHH của HC là FeSO4
Bài 2: Hãy tìm CTHH của một hợp chất có chứa27,1%Fe;16,5%N và còn lại là O . Biết khối lượng mol của hợp chất là 85 g/mol

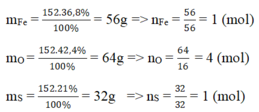
Vậy trong 1 phân tử hợp chất có 1 nguyên tử Fe, 4 nguyên tử O, 1 nguyên tử S.
⇒ CTHH là FeSO4.

%mO = 100 - 27,27 = 72,73%
Gọi oxit có công thức đơn giản nhất là CxOy
=> x:y = 27,27/12 : 72,73/16=1:2 <=> CTĐGN là CO2 . Mà khối lượng mol của hợp chất bằng 44 nên CT phân tử của oxit cũng là CO2%mO = 100 - 27,27 = 72,73%
Gọi oxit có công thức đơn giản nhất là CxOy
=> x:y = 27,2712:72,731627,2712:72,7316=1:2 <=> CTĐGN là CO2 . Mà khối lượng mol của hợp chất bằng 44 nên CT phân tử của oxit cũng là CO2
Từ đầu đến cũng là CO2 là đc nha, phần còn lại mình vt nhầm tí:)

% Fe: %S : %O = 36,8 : 21 : 42,2
--> n Fe: n S : n O = 36,8/56 : 21/32 : 42,2/16
=0,66:0,66: 2,63
=1:1:4
M=152
-->CTHH: FeSO4
- 0,5 mol FeSO4 có
+0,5 mol Fe, 0,5 mol S và 0,5.4=2 mol O

Khối lượng mol của Fe là MFe = = 56 g
Khối lượng mol của S là: MS = = 32 g
Khối lượng mol của O là: MO = = 64 g
Gọi công thức hóa học của hợp chất là FeXSyOz, ta có:
56 . x = 56 => x = 1
32 . y = 32 => y = 1
16 . z = 64 => z = 4
Vậy hợp chât có công thức hóa học là FeSO4
Khối lượng mol của Fe là \(M_{Fe}\) = (152 . 36,8)/100 = 56 g
Khối lượng mol của S là: \(M_S\) = (152 . 21)/100 = 32 g
Khối lượng mol của O là: \(M_O\) = (152 . 42,2)/100 = 64 g
Gọi công thức hóa học của hợp chất là \(Fe_xS_yO_z\), ta có:
\(56.x=56\Rightarrow x=1\)
\(32.y=32\Rightarrow y=1\)
\(16.z=64\Rightarrow z=4\)
Vậy hợp chât có công thức hóa học là \(FeSO_4\)

mS = 80 . 40% = 32 (g)
nS = 32/32 = 1 (mol)
mO = 80 - 32 = 48 (g)
nO = 48/16 = 3 (mol)
CTHH: SO3

phần trăm còn lại của oxi là : 100%-28,57%-14,2%=57,23%
\(m_{Mg}=\dfrac{85\cdot28,57}{100}\approx24\left(g\right)\)
\(m_C=\dfrac{85\cdot14,2}{100}\approx12\left(g\right)\)
\(m_O=\dfrac{85\cdot57,23}{100}\approx48\left(g\right)\)
=> \(n_{Mg}=\dfrac{24}{24}=1\left(mol\right);n_C=\dfrac{12}{12}=1\left(mol\right);n_O=\dfrac{48}{16}=3\left(mol\right)\)
=> trong 1 phân tử có 1 nguyên tử Mg, 1 nguyên tử O, 3 nguyên tử Mg
=> CTHH:MgCO3
Gọi CTHH của hợp chất là FexSyOz
=> 56x = 152.36,8% => x = 1
32y = 152.21% => y = 1
16z = 152 - 56.1 - 32.1=64 => z = 4
Vậy CTHH của hợp chất là FeSO4