Hòa tan hoàn toàn 8,45 gam một kim loại hóa trị II bằng dung dịch HCl. Cô cạn dung dịch sau phản ứng thu được 17,68 gam muối khan. Kim loại trên là kim loại nào sau đây?
A. Fe
B. Mg
C. Zn
D. Ba
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Ta có: M + 2HCl → MCl2 + H2↑.
+ Ta có mCl = 17,68 – 8,45 = 0,26 mol = ne trao đổi.
⇒ nM = 0,26÷2 = 0,13 mol.
⇒ MM = 8,45 ÷ 0,13 = 65

Đáp án C
Ta có: M + 2HCl → MCl2 + H2↑.
+ Ta có mCl = 17,68 – 8,45 = 0,26 mol = ne trao đổi.
⇒ nM = 0,26÷2 = 0,13 mol.
⇒ MM = 8,45 ÷ 0,13 = 65

Đáp án B
M + 2HCl → MCl2 + H2
M (M+71)
8,45g 17,68g
=> 17,68.M = 8,45.(M+71)
=> M = 65 (Zn)

Đáp án B
M + 2HCl -> MCl2 + H2
M g (M + 71)g
8,45g 17,68g
=> 17,68.M = 8,45.(M + 71)
=> M = 65g (Zn)

Đáp án C
Gọi công thức của hai muối trong hỗn hợp ban đầu là A2CO3 và BCO3.
Có các phản ứng:
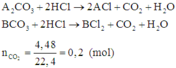
Quan sát phản ứng thấy khi cho hỗn hợp phản ứng với dung dịch HCl thì mỗi gốc C O 3 2 - trong muối được thay thế bởi hai gốc Cl-.
Có 1 mol C O 3 2 - bị thay thế bởi 2 mol Cl- thì khối lượng của muối tăng: (2.35,5 -60) = 11(gam)
Do đó khối lượng muối khan thu được khi cô cạn dung dịch là:
mmuối clorua = mmuối cacbonat + 0,2.11 = 23,8 + 0,2.11= 26 (gam)

Gọi A là kim loại hóa trị II;
PTHH:
A + 2HCl => ACl2 + H2
nA = m/M = 13/A (mol)
nmuối = m/M = 2,7/(A+71)
Đặt các số mol lên phương trình
Theo phương trình ta có:
13/A = 2,7/(A+71)
Từ phương trình suy ra kết quả của A rồi tìm tên kim loại
Giải thích: Đáp án C
BTKL: nCl- = ( mmuối – mKL)/35,5 = ( 17,68 – 8,45) / 35,5 = 0,26 (mol) = nHCl
M + 2HCl → MCl2 + H2↑
0,13 ← 0,26 (mol)
=> MM = 8,45 : 0,13 = 65 (Zn)