Cho hỗn hợp X gồm Al và Mg tác dụng với 1 lít dung dịch gồm AgNO3 a mol/l và Cu(NO3)2 2a mol/l, thu được 14,0 gam chất rắn Y. Cho Y tác dụng với dung dịch H2SO4 đặc, nóng (dư), thu được 2,24 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
A. 0,15.
B. 0,10.
C. 0,05.
D. 0,20.

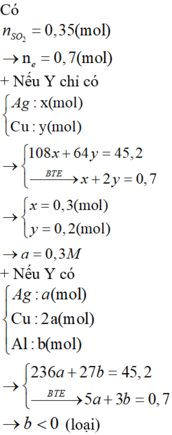

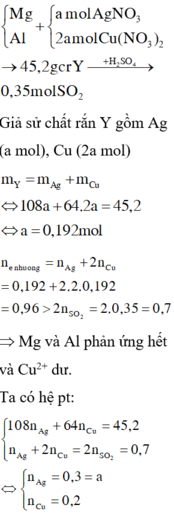

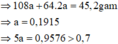

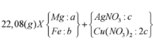
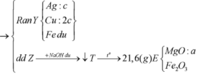
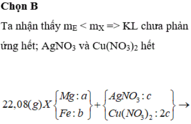
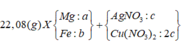
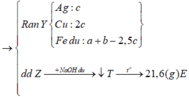
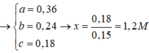
Giải thích: Đáp án B
m(hh Y) = mCu + mAg = 64 . nCu + 108 . nAg = 14 (1)
Cho Y + H2SO4:
Số mol e trao đổi = 2nCu + 1nAg = 2nSO2 = 2.0,1 = 0,2 (2)
Giải (1) và (2) : nAg = 0,1 mol; nCu = 0,05 mol
Theo bài cho nồng độ Cu(NO3)2 gấp 2 lần AgNO3 như vậy lượng Cu(NO3)2vẫn còn dư sau phản ứng.
→ kết quả trên là hợp lí, hỗn hợp Mg, Al đã phản ứng hết với Ag+, đến lượt Cu2+ thì mới phản ứng được 0,05 mol thì hết, còn lại 0,15 mol dư.
Như vậy ta có nAgNO3 = nAg = 0,1 mol a = 0,1 mol