Hòa tan hết 13,04 gam hỗn hợp X gồm Fe3O4, Fe và Al (trong đó Al chiếm 27/163 về khối lượng) bằng 216,72 gam dung dịch HNO3 25% (dùng dư), thu được 228,64 gam dung dịch Y và thoát ra một chất khí N2 duy nhất. Để tác dụng tối đa các chất trong dung dịch Y cần 0,85 mol KOH. Nếu cô cạn dung dịch Y thu được chất rắn T. Nung T đến khối lượng không đổi thu được m gam chất rắn. Giá trị m gần nhất với:A. 15,8. B. 16,9. C. 14,6. D. 17,7.
A. 15,8.
B. 16,9.
C. 14,6.
D. 17,7.




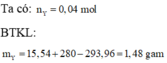





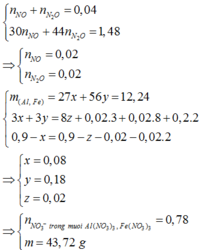
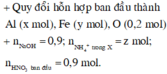
Đáp án B
mAl = 13,04.27/163 = 2,16g => nAl = 2,16: 27 = 0,08 mol
mHNO3 = 216,72.25% = 54,18g => nHNO3 = 54,18: 63 = 0,86 mol
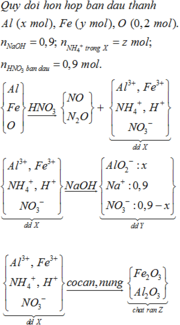
- Giả sử dung dịch Y có NH4+, ta có sơ đồ sau:
Bảo toàn khối lượng: mX + mdd HNO3 = mdd Y + mN2
=> mN2 = 13,04 + 216,72 – 228,64 = 1,12g => nN2 = 1,12: 28 = 0,04 mol
Bảo toàn nguyên tố Al: nAl = nKAlO2 = 0,08 mol
Bảo toàn nguyên tố K: nKOH = nKAlO2 + nKNO3 => nKNO3 = 0,85 – 0,08 = 0,77 mol
Bảo toàn nguyên tố N: nHNO3 = nNO3(Y) + nNH4 + 2nN2. Mà nNO3(Y) = nKNO3 = 0,77 mol
=> nNH4 = 0,86 – 0,77 – 2.0,04 = 0,01 mol
Gọi số mol Fe3O4 và Fe lần lượt là x và y
Bảo toàn electron: nFe3O4 + 3nFe + 3nAl = 8nNH4 + 10nN2 (Với Fe3O4: 3Fe+8/3 → 3Fe3+ + 1e)
=> x + 3y = 8.0,01 + 10.0,04 – 3.0,08
=> x + 3y = 0,24 mol (1)
Lại có: mX = 13,04 = mFe3O4 + mFe + mAl => 232x + 56y = 13,04 – 0,08.27 = 10,88g (2)
Từ (1,2) => x = 0,03 ; y = 0,07 mol
- Xét sơ đồ phản ứng trên,Chất rắn T gồm Fe2O3 và Al2O3.
Bảo toàn nguyên tố: nFe2O3 = ½ (nFe + 3nFe3O4) = 0,08 mol
nAl2O3 = ½ nAl = 0,04 mol
=> m = mFe2O3 + mAl2O3 = 0,08.160 + 0,04.102 = 16,88g (Gần nhất với giá trị 16,9g)