Nhiệt phân hoàn toàn R(NO3)2 (với R là kim loại) thu được 8 gam một oxit kim loại và 5,04 lít hỗn hợp khí X gồm NO2 và O2 (đo ở đktc). Khối lượng của hỗn hợp khí X là 10 gam. Muối R(NO3)2 là?
A.Mg(NO3)2.
B.Cu (NO3)2 .
C.Fe(NO3)2.
D. Zn(NO3)2.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n X = 6 , 048 22 , 4 = 0 , 27 m o l .
Đặt
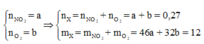
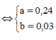

Cách 1: Áp dụng định luật bảo toàn khối lượng, không xét đến trong quá trình nhiệt phân A có thay đổi số oxi hóa hay không.Áp dụng định luật bảo toàn khối lượng ta có:
![]()
Bảo toàn nguyên tố N:
![]()

![]()
Vậy đáp án đúng là D.
Cách 2: Xét tỉ lệ mol giữa NO2 và O2 để tìm dạng phản ứng nhiệt phân của A(NO3)2 . Có
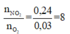
Khi đó trong quá trình nhiệt phân, A có sự thay đổi số oxi hóa từ +2 lên +3:
![]()
Quan sát 4 đáp án nhận thấy chỉ có Fe(NO3 )2 thỏa mãn.
Đáp án D.

Đáp án A
Vì nhiệt phân R(NO3)2 thu được oxit kim loại nên hỗn hợp khí X thu được gồm NO2 và O2.
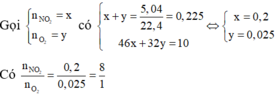
Do đó hóa trị của R trong muối và trong oxit là khác nhau. Căn cứ vào 4 đáp án ta được Fe(NO3)2.

Đáp án : A
nkhí = 0,225 mol = nNO2 + nO2
Bảo toàn N : nNO2 = 2nM(NO3)2 = 0,2 mol
=> nO2 = 0,025 mol
Bảo toàn khối lượng : mM(NO3)2 = mrắn + mO2 + mNO2
=> mM(NO3)2 = 18g => MM(NO3)2 = 180g => M = 56 (Fe)
nRBr = nFeBr2 = a mol
Ag+ + Br- -> AgBr
Ag+ + Fe2+ -> Ag + Fe3+
X + AgNO3 dư : kết tủa gồm : 3a mol AgBr và a mol Ag
=> a = 0,1 mol
=> MR = 18 (NH4)
Trong ion R+ (NH4+) có số proton = pN + 4pH = 11
pFe = 26
=> Tổng p = 37

\(M_{hh}=21,6\cdot2=43,2\)(g/mol)
Dùng phương pháp đường chéo :
=> \(\hept{\begin{cases}V_{NO2}=5,6\left(l\right)\\V_{O2}=1,4\left(l\right)\end{cases}}\) \(\Rightarrow\hept{\begin{cases}n_{NO_2}=\frac{5,6}{22,4}=0,25\left(mol\right)\\n_{O2}=\frac{1,4}{22,4}=0,0625\left(mol\right)\end{cases}}\)
PTHH : \(2R\left(NO_3\right)_n-t^o->R_2O_n+2nNO_2+\frac{n}{2}O_2\)
Theo pthh : \(n_{R\left(NO_3\right)_n}=\frac{n_{NO_2}}{n}=\frac{0,25}{n}\left(mol\right)\)
=> \(\frac{23,5}{R+62n}=\frac{0,25}{n}\)
=> \(R=32n\)
Ta có bảng sau :
| n | I | II | III |
| R | 32 | 64 | 96 |
| KL | Loại | Cu | Loại |
Vậy công thức của muối là : \(Cu\left(NO_3\right)_2\)

Đáp án A
, nkhí = 0,225 mol = nNO2 + nO2
Bảo toàn N : nNO2 = 2nM(NO3)2 = 0,2 mol
=> nO2 = 0,025 mol
Bảo toàn khối lượng : mM(NO3)2 = mrắn + mO2 + mNO2
=> mM(NO3)2 = 18g => MM(NO3)2 = 180g => M = 56 (Fe)
,nRBr = nFeBr2 = a mol
Ag+ + Br- -> AgBr
Ag+ + Fe2+ -> Ag + Fe3+
X + AgNO3 dư : kết tủa gồm : 3a mol AgBr và a mol Ag
=> a = 0,1 mol
=> MR = 18 (NH4)
Trong ion R+ (NH4+) có số proton = pN + 4pH = 11
,pFe = 26
=> Tổng p = 37
=>A

Gọi hóa trị của R là n và số mol Sn và R lần lượt là a và b mol
+/ Khi phản ứng với HCl :
Sn + HCl → SnCl2 + H2
R + nHCl → RCln + 0,5nH2
+/ Khi đốt trong oxi :
Sn + O2 → SnO2
2R + 0,5nO2 → R2On
=> Ta có : nH2 = a + 0,5nb = 0,225 mol
Và nO2 = a + 0,25nb = 0,165 mol
=> a = 0,105 mol ; nb = 0,24 mol
Có mmuối = 0,105.190 + 0,24/n . (R + 35,5n) = 36,27
=>R = 32,5n
=>Cặp n =2 ; R =65 (Zn) thỏa mãn
=>B

Đáp án : D
Xét X : có nX = 0,14 mol ; MX = 321/7g
Áp dụng qui tắc đường chéo => nCO2 = 0,01 mol ; nNO2 = 0,13 mol
Kết tủa 2,33g chính là BaSO4 => nBaSO4 = nSO2 = 0,01 mol
Khi khí B + HNO3 :
4NO2 + O2 + 2H2O -> 4HNO3
,x -> 0,25x
=> nB = nSO2 + nCO2 + nNO2 + nO2
=> 0,495 = 0,01 + 0,01 + 0,13 + x + 0,25x
=> x = 0,276 mol
Bảo toàn nguyên tố :
,nFeCO3 = nCO2 = 0,01 ; nCu(NO3)2 = ½nNO2 = 0,203 mol
=> nO(X) = 3nFeCO3 + 6nCu(NO3)2 = 1,248 mol
Vì %mO = 47,818% => m = 41,76g
Đáp ánC
Đặt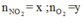
Ta có hệ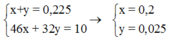
Bảo toàn nguyên tố N ta có
Bảo toàn khối lượng ta lại có: