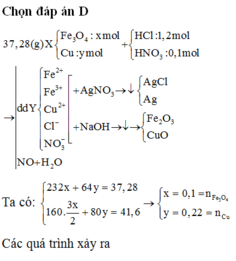
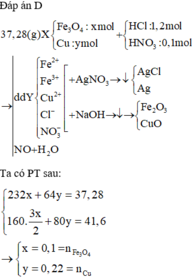
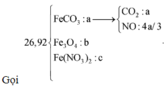
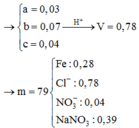
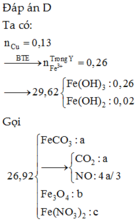
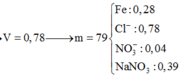
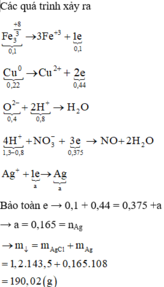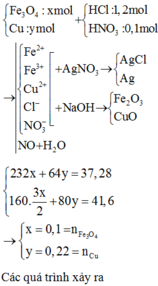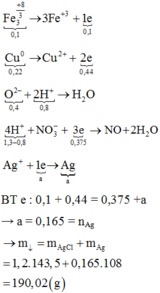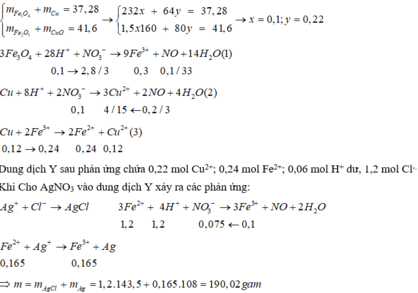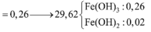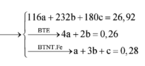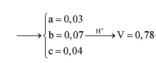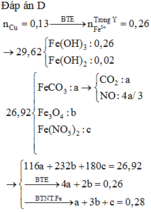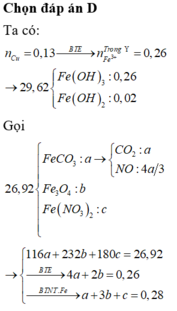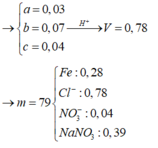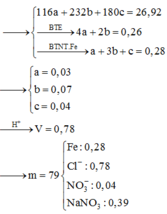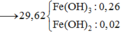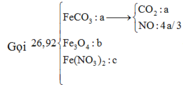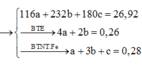Hòa tan hết 37,28 gam hỗn hợp X gồm F e 3 O 4 , Cu trong 500 ml dung dịch chứa HCl 2,4M và H N O 3 0,2M, thu được dung dịch Y và khí NO. Cho dung dịch NaOH dư vào dung dịch Y, lọc, lấy kết tủa nung trong không khí đến khối lượng không đổi được 41,6 gam chất rắn Z. Cho dung dịch A g N O 3 dư vào dung dịch Y có khí NO thoát ra và thu được m gam kết tủa. Biết sản phẩm khử duy nhất của N O - 3 là NO, C l - không bị oxi hóa trong các quá trình phản ứng, các phản ứng hóa học xảy ra hoàn toàn. Giá trị của m là
![]()
![]()
![]()
![]()