Điện phân với điện cực trơ dung dịch chứa 0,3 mol AgNO3 bằng cường độ dòng điện 2,68 ampe, trong thời gian t (giờ) thu được dung dịch X. Cho 22,4 gam bột Fe vào dung dịch X thấy thoát ra khí NO ( sản phẩm khử duy nhất) thu được 34,28 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của t là
A. 1,00
B. 1,20
C. 1,25
D. 1,40


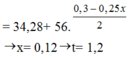

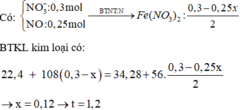
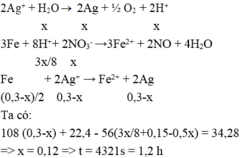

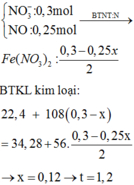
Đáp án B
4AgNO3 + 2H2O → d p d d 4Ag + 4HNO3 + O2
x → x (mol)
Dd X gồm: HNO3: x (mol); AgNO3 dư : 0,3 – x (mol)
Cho Fe vào dd X, sản phẩm thu được có Fe dư ( Vì mAg < 0,3. 108 < 34,28)
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,25x ← x → 0,25x
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
0,125x ←0,25x
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
(0,15-0,5x)←(0,3-x)
∆m rắn tăng = mAg sinh ra – mFe pư
=> 34,28 – 22,4 = ( 0,3 – x). 108 – ( 0,25x + 0,125x + 0,15– 0,5x). 56
=> 11, 88 = 24-101x
=> x = 0,12 (mol)
=> nAg+ bị điện phân = 0,12 = It/F
=> t = 0,12. 96500/ 2,68 = 4320 (s) = 1,2 h