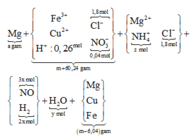
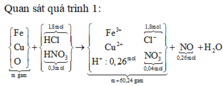
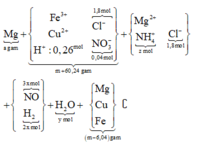
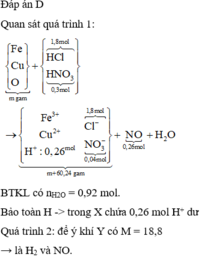
Hòa tan m gam hỗn hợp A gồm FexOy, Fe và Cu bằng dung dịch chứa 1,8 mol HCl và 0,3 mol HNO3 sau phản ứng thu được 5,824 lít khí NO ( đktc, sản phẩm khử duy nhất) và dung dịch X chứa ( m+60,24) gam chất tan. Cho a gam Mg vào dung dịch X, kết thúc phản ứng thu được (m-6,04) gam rắn và hỗn hợp Y gồm hai khí ( trong đó có một khí hóa nâu trong không khí) có tỉ khối so với He bằng 4,7. Giá trị a gần nhất với:
A. 23,0
B. 24,0
C. 21,0
D. 22,0

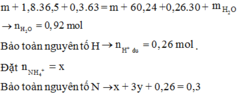
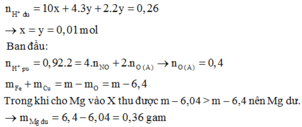
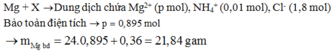


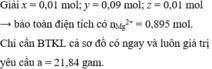

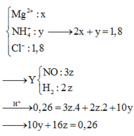
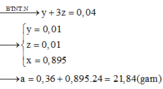
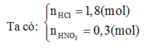
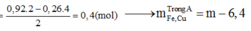

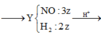
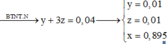

Đáp án D
nHCl = 1,8 (mol); nHNO3 = 0,3 (mol); nNO = 0,26 (mol)
Quy đổi A thành Fe ( a) Cu ( b) ; O ( c) mol
Bảo toàn e ta có: 3a + 2b = 2c + 0,26.3 (1)
MY = 18,8 => 2 khí đó là H2 và NO. Vậy trong dd X phải có H+ dư
Dd X chứa: Fe3+ (a); Cu2+ (b); Cl- (1,8), NO3- ( 0,3 – 0,26 = 0,04); H+ dư = ( 2,1 – 0,26.4 -2c)
=> 56a + 64b + 35,5.1,8 + 62.0,04 + 1,06 – 2c = ( 56a + 64b + 16c) + 60,24
=> c = 0,4 (mol)
Vậy H+ dư = 0,26 (mol)
mFe+ Cu = mA – mO = m – 6,4. Nhưng khi cho Mg vào X thì thu được m – 6,04 gam chất rắn
=> Đã có Mg dư 6,4 – 6,04 = 0,36 gam. Vậy Fe3+, Cu2+ đã bị đẩy ra hết
MY = 18,8 (g/mol) dùng quy tắc đường chéo => nNO = 3/2 nH2.
Đặt nNO = 3x ; nH2 = 2x; nNH4+ = y (mol)
Có H2 thoát ra nên NO3- hết, bảo toàn N: 3x + y = 0,04 (3)
nH+ = 4.3x + 2.2x + 10y = 0,26 (4)
Từ ( 3) và (4) => x = y = 0,01 (mol). Từ (1) => 3a + 2b = 1,58
Bảo toàn e: 2nMg = 3a + 2b + 3.3x + 2.2x + 8y
=> nMg = (1,58 + 13. 0,01 + 8.0,01) : 2
= 0,895
=> mMg ban đầu = 0,895.24 + 0,36 = 21,84 (g) ≈ 22 (g)
Chú ý:
Tạo muối NH4+