Cho 5 gam oxit kim loại M (có hóa trị II) vào dung địch HCl dư, sau khi phản ứng kết thúc thu được 11,875 gam muối. Kim loại M là
A. Mg.
B. Ca.
C. Cu.
D. Zn.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol M là a
\(PTHH:MO+2HCl\rightarrow MCl_2+H_2O\)
__________a __________ a__________
Ta có \(a\left(M+16\right)=5\)
Lại có \(a.\left(M+71\right)=11,875\)
\(\rightarrow\frac{M+16}{M+71}=\frac{5}{11,875}\)
\(\rightarrow\) M=24
->M là Mg
Vậy chọn A

a) \(2M+2nHCl\rightarrow2MCl_n+nH_2\)
\(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,5}{n}\left(mol\right)\)
Ta có : \(M_M=\dfrac{16,25}{\dfrac{0,5}{n}}=32,5n\)
Chạy nghiệm n
n=1 => M=32,5 (loại)
n=2 => M=65 ( chọn)
n=3 => M=97,5 (loại)
Vậy M là Zn
b) Ta có : \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
=> \(V_{HCl}=\dfrac{0,5}{0,2}=2,5\left(lít\right)\)

Gọi công thức hóa học của oxit là RO
→Phương trình hóa học: RO+2HCl→RCl2+H2O
nRO:8,1\(R+16nRO)= nRCl2: 13,6\R+35,5.2
⇔ 8,1.(R+71)=13,6.(R+16)
⇔ 8,1R+575,1=13,6R+217,6
⇔ 8,1R−13,6R=−575,1+217,6
⇔ −5,5R=−357,5
⇔ R=65 (Zn)
→ R là nguyên tố Kẽm (Zn)
công thức hóa học: ZnO

Đáp án B.
Số mol H2 là:
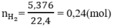
Số mol HCl nHCl = 0,5.1 = 0,5(mol)
2M + 2nHCl → 2MCln + nH2
Số mol HCl phản ứng: nHCl = 2. nH2 = 2.0,24 = 0,48(mol). So với ban đầu HCl phản ứng còn dư
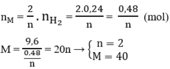
Vậy M là Ca

`MO + 2HCl -> MCl_2 + H_2O`
Theo PT: `n_(MO) = (n_(HCl))/2`
`<=> 8/(M_M +16) = (0,4)/2`
`<=> M_M = 24`
`=>M` là `Mg`.
\(MO+2HCl\rightarrow MCl_2+H_2O\)
Ta có : \(n_{MO}=\dfrac{1}{2}n_{HCl}=0,2\left(mol\right)\)
=> \(M_{MO}=\dfrac{8}{0,2}=40\)
=> M=24 (Mg)
Đáp án A
Phương trình hóa học: M O + 2 H C l → M C l 2 + H 2 O