Nung 6,58 gam Cu NO 3 2 trong bình kín, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn hỗn hợp X vào nước được 300 ml dung dịch Y. pH của dung dịch Y là
A. 2,0.
B. 1,7.
C. 1,3.
D. 1,0
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : B
Cu(NO3)2 -> CuO + 2NO2 + ½ O2
, x -> 2x -> 0,5x mol
, mCu(NO3)2 - mrắn = mkhí => x = 0,015 mol
2NO2 + ½ O2 + H2O -> 2HNO3
=> nHNO3 = 0,03 mol => CHNO3 = 0,1M => pH = 1

Chọn D
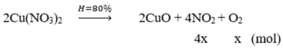
m c/rắn giảm = m khí = 6,58 – 4,96 = 1,62 gam
→ mNO2 + mO2 = 1,62
→ 46.4x + 32x =1,62 → x = 0,0075 mol
nNO2 = nHNO3 = nH+ = 0,03
→ [H+] = 0,1 => pH = 1,0

Cách 1: Ta nhận thấy, khối lượng chất rắn sau khi nung giảm 1,62 gam. Đó chính là khối lượng NO2 và O2:
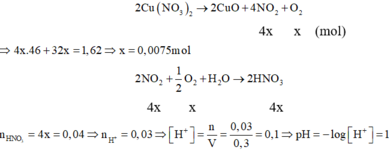
Đáp án C.

Đáp án A
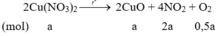
Bảo toàn khối lượng: 6,58 = 4,96 + 2a.46 + 0,5a.32 Þ a = 0,015 mol


Đáp án : B
Cu(NO3)2 -> CuO + 2NO2 + ½ O2
4NO2 + O2 + 2H2O -> 4HNO3
, nHNO3 = 10-pH .0,3 = 0,03 mol
=> nNO2 = 0,03 ; nO2 = 0,0075 mol
=> a = mCu(NO3)2 bđ – nNO2 – nO2 = 4,96g
Đáp án D