Dung dịch A có chứa 5 ion: Mg 2 + , Ba 2 + , Ca 2 + và 0,1 mol Cl- và 0,2 mol NO 3 - . Thêm dần V ml dung dịch K 2 CO 3 1M vào dung dịch A đến khi thu được lượng kết tủa lớn nhất. V có giá trị là
A. 150 ml.
B. 300 ml.
C. 200 ml.
D. 250 ml.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảo toàn điện tích :
$2n_{Mg^{2+}} + 2n_{Ca^{2+}} = n_{Cl^-} + n_{NO_3^-} = 0,3(mol)$
$\Rightarrow n_{Mg^{2+}} + n_{Ca^{2+}} = 0,15(mol)$
$Mg^{2+} + CO_3^{2-} \to MgCO_3$
$Ca^{2+} + CO_3^{2-} \to CaCO_3$
$\Rightarrow n_{Na_2CO_3} = n_{CO_3^{2-}} = n_{Mg^{2+}} + n_{Ca^{2+}} = 0,15(mol)$
$\Rightarrow V = \dfrac{0,15}{2} = 0,075(lít)$

Đáp án C
Nhận thấy Mg2+ và H+ không thể tồn tại cùng với CO32-
→Dung dịch A chứa K+, NH4+, CO32- và ion âm An-
Theo định luật bảo toàn điện tích: 0,15+ 0,25=0,15.2+ n.nAn-
→ n.nAn-= 0,1 mol → Anion còn lại trong dung dịch A là Cl-
→Dung dịch A chứa K+, NH4+, CO32- và Cl-
→mchất rắn khan= 0,15.39 + 0,25.18+ 0,15.60 + 0,1.35,5= 22,9 gam
Dung dịch B chứa H+, Mg2+, SO42- và NO3-
Chú ý khi cô cạn thì axit HNO3 (0,2 mol) sẽ bay hơi cùng nước
→mchất rắn khan= mMg2++ mSO4(2-)+ mNO3- dư
= 0,1.24+ 96.0,075+ 0,05.62=12,7 gam

Câu 1:
Theo ĐLBT ĐT, có: x + 2y = 0,1.2 + 0,2.3 (1)
Theo ĐLBT KL, có: 35,5x + 96y = 44,4 - 0,1.56 - 0,2.27 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,4\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
Câu 2:
Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 24y = 5,1 (1)
Có: \(n_{N_2}=0,05\left(mol\right)\)
Theo ĐLBT e, có: 3x + 2y = 0,05.10 (2)
Từ (1) và (2) \(\Rightarrow x=y=0,1\left(mol\right)\)
BTNT Al và Mg, có: \(n_{Al\left(NO_3\right)_3}=n_{Mg\left(NO_3\right)_2}=0,1\left(mol\right)\)
⇒ m muối = 0,1.213 + 0,1.148 = 36,1 (g)
Câu 3:
Có: \(n_{H^+}=0,2.0,01+0,2.0,02.2=0,01\left(mol\right)\)
\(n_{OH^-}=0,3.0,03=0,009\left(mol\right)\)
PT: \(H^++OH^-\rightarrow H_2O\)
__0,01___0,009 (mol)
⇒ H+ dư và nH+ (dư) = 0,001 (mol)
\(\Rightarrow\left[H^+\right]=\dfrac{0,001}{0,2+0,3}=0,002\left(M\right)\)
\(\Rightarrow pH=-log0,002\approx2,7\)
Bạn tham khảo nhé!

Đáp án B
Loại ngay A và D do H+ và CO32- không tồn tại trong cùng 1 dung dịch
Xét B: nK+ + nNH4+ = 0,15 + 0,25 = 0,4 mol; nCl- + 2nCO32- = 0,1 + 2.0,15 = 0,4 mol
=> thỏa mãn định luật bảo toàn điện tích
Xét C: nK+ + 2nMg2+ = 0,15 + 2.0,1 = 0,35 mol; nCl- + 2nSO42- = 0,1 + 2.0,075 = 0,25 mol
=> không thỏa mãn định luật bảo toàn điện tích

Vì có Mg2+ nên dung dịch không có OH- → Loại B và C
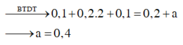
Đáp án A

Đáp án B
Để dung dịch tồn tại thì các ion không phản ứng với nhau và định luật bảo toàn được thỏa mãn. Ở đây chỉ có đáp án B thỏa mãn.
Đáp án A