Vì sao người ta có thể điều chế hiđro clorua (HCl), hiđro florua (HF) bằng cách cho dung dịch H 2 SO 4 đặc tác dụng với muối clorua hoặc florua, nhưng không thể áp dụng phương pháp này để điều chế hiđro bromua (HBr) hoặc hiđro iotua (HI) ? Viết PTHH của các phản ứng điều chế các hiđro halogenua.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Người ta có thể điều chế Cl 2 , Br 2 , I 2 bằng cách cho hỗn hợp dung dịch H 2 SO 4 đặc và MnO 2 tác dụng với muối clorua, bromua, iotua
Các sản phẩm trung gian là HCl, HBr, HI bị hỗn hợp ( MnO 2 + H 2 SO 4 ) oxi hoá thành Cl 2 , Br 2 , I 2 . Các PTHH có thể viết như sau :
NaCl + H 2 SO 4 → Na HSO 4 + HCl
MnO 2 + 4HCl → Mn Cl 2 + Cl 2 + 2 H 2 O
Các phản ứng cũng xảy ra tương tự đối với muối NaBr và NaI.
Không thể áp dụng phương pháp trên để điều chế F 2 vì hỗn hợp oxi hoá ( MnO 2 + H 2 SO 4 ) không đủ mạnh để oxi hoá HF thành F 2
Cách duy nhất điều chế F 2 là điện phân KF tan trong HF lỏng khan Dùng dòng điện một chiểu 8-12 von ; 4000 - 6000 ampe ; Bình điện phân có catôt làm bằng thép đặc biệt hoặc bằng đồng và anôt làm bằng than chì (graphit).
Ở catot: 2 H + + 2 e → H 2
Ở anot: 2 F - → F 2 + 2 e

số mol kẽm tham gia phản ứng là:\(n_{Zn}=\frac{m}{M}=\frac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 (mol)
a, thể tích khí hiđro thu được là:\(V_{H_2}=n_{H_2}\times22,4=0,1\times22,4=2,24\left(l\right)\)
b,khối lượng HCl cần dùng là:\(m_{HCl}=n_{HCl}\times M=0,2\times65=13\left(g\right)\)

a)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2----------->0,2----->0,3
=> \(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b) \(m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)
c)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
0,3<----------------0,3
=> \(m_{H_2SO_4}=0,3.98=29,4\left(g\right)\)
\(a,n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2--------------->0,2------->0,3
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\\ b,m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)
c, PTHH:
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,2<------------------0,2
\(m_{H_2SO_4}=0,2.98=19,6\left(g\right)\)

Đáp án C
Để điều chế muối sắt (III) cần dùng HCl tác dụng với oxit sắt (III)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O

a)
\(PTHH:2Al+6HCl->2AlCl_3+3H_2\)
1,3<---4<-------1,3<---------2
b)
\(n_{H_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{44,8}{22,4}=2\left(mol\right)\)
\(m_{AlCl_3}=n\cdot M=1,3\cdot\left(27+35,5\cdot3\right)=173,55\left(g\right)\)
\(m_{Al}=n\cdot M=1,3\cdot27=35,1\left(g\right)\)

a) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b+c) Áp dụng Định luật bảo toàn khối lượng:
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(\Rightarrow m_{ZnCl_2}=m_{Zn}+m_{HCl}-m_{H_2}=6,5+7,3-1=12,8\left(g\right)\)
Có 3 lọ mất nhãn đựng 3 dung dịch không màu NaCl H2SO4 K2SO4 trình bày phương pháp hóa học để nhận ra các chất trên. Viết phương trình phản ứng.

\(n_{Fe}=\dfrac{m}{M}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ PTHH:Fe+2HCl->FeCl_2+H_2\)
tỉ lệ: 1 : 2 : 1 : 1
n(mol) 0,2--->0,4------->0,2----->0,2
\(m_{FeCl_2}=n\cdot M=0,2\cdot\left(56+35,5\cdot2\right)=25,4\left(g\right)\\ V_{H_2\left(dktc\right)}=n\cdot22,4=0,2\cdot22,4=4,48\left(l\right)\\ V_{H_2\left(dkc\right)}=n\cdot24,79=4,958\left(l\right)\)
a) \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b) \(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo phương trình hóa học: \(n_{H_2}=n_{Fe}=o,2\left(mol\right)\)
\(V_{H_2\left(dktc\right)}=n_{H_2}\times22,4=0,2\times22,4=4,48\left(l\right)\)
\(V_{H_2\left(dkc\right)}=n_{H_2}\times24,79=0,2\times24,79=4,96\left(l\right)\)
c) Theo phương trình hóa học: \(n_{FeCl_2}=n_{H_2}=0,2\left(mol\right)\)
\(m_{FeCl_2}=n_{FeCl_2}\times M_{FeCl_2}=0,2.127=25,4\left(g\right)\)
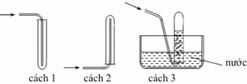
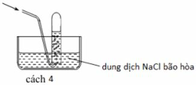
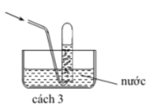
Điều chế HF, HCl bằng cách cho H 2 SO 4 đặc tác dụng với muối florua, clorua vì H 2 SO 4 à chất oxi hoá không đủ mạnh để oxi hoá được HF và HCl. Nói cách khác, HF và HCl có tính khử yếu, chúng không khử được H 2 SO 4 đặc
Ca F 2 + H 2 SO 4 → Ca SO 4 + 2HF
NaCl + H 2 SO 4 → NaH SO 4 + HCl
Nhưng không thể dùng phương pháp trên để điều chế HBr và HI vì H 2 SO 4 đặc oxi hoá được những chất này thành Br 2 và I 2 . Nói cách khác, HBr và HI là những chất có tính khử mạnh hơn HCl và HF.
NaBr + H 2 SO 4 → HBr + NaH SO 4
2HBr + H 2 SO 4 → Br 2 + SO 2 + 2 H 2 O
NaI + H 2 SO 4 → NaH SO 4 + HI
2HI + H 2 SO 4 → I 2 + SO 2 + 2 H 2 O