Cho 3,16 gam KMnO4 tác dụng với dung dịch HCl (dư), sau khi phản ứng xảy ra hoàn toàn thì số mol HCl bị oxi hoá là
A. 0,05
B. 0,10
C. 0,02
D. 0,16
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D
n K M n O 4 = 3 , 16 158 = 0,02 (mol
Bảo toàn electron: nHCl (bị oxi hóa) = n K M n O 4 = 5.0,02 = 0,1 (mol)

PT : KClO3 + 6HCl→ KCl + 2,5Cl2 + 3H2O
=> số mol HCl bị OXH = số mol HCl chuyển thành Cl2
=>n Cl2 = 2,5 n KClO3 = 0,125 mol
=> n HCl bị oxh = 2 n Cl2 = 0,25 mol
=>A

Đáp án A
Số mol K2Cr2O7 là: n K 2 Cr 2 O 7 = 0 , 02 mol
Sơ đồ phản ứng: K 2 Cr 2 + 6 O 7 ⏟ chất oxi hóa + H C l - 1 ⏟ c h ấ t k h ử v à m ô i t r ư ờ n g → K C l - 1 + C r + 3 C l 3 - 1 + C l 2 0 + 2 H 2 O
Theo sơ đồ phản ứng thì HCl bị oxi hoá sẽ chuyển hết về Cl2. Bảo toàn mol electron ta có:
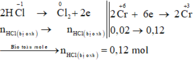

Đáp án C
Các phương trình phản ứng :
M tác dụng với O2: 4 M + 2 n O 2 → t 0 2 M n O n
Chất rắn sau phản ứng tác dụng với dung dịch HCl thu được khí H2, chứng tỏ chất rắn sau có M dư nên O2 hết - chất rắn sau gồm M dư và M2On :
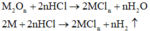
Tính toán:
Số mol H2 thu được là: n H 2 = 13 , 44 22 , 4 = 0 , 6 m o l
Sơ đồ phản ứng:
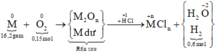
Các quá trình nhường, nhận electron cho cả quá trình:
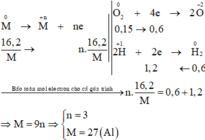
2KMnO4 + 16HCl --> 2KCl + 2MnCl2 + 8H2O + 5Cl2
Ta có nKMnO4 = 0,02
HCl có 2 phần, 1 là tạo môi trường, 2 là bị oxi hóa,
Từ phương trình, ta thấy: Cl- trong HCl chỉ bị thay đỗi số oxi hóa trong Cl2 (từ -1 lên 0), trong các muối
MnCl2 và KCl thì vẫn giữ nguyên là -1
=> số mol HCl bị oxi hóa= số mol Cl- bị oxi hóa=2nCl2=(5*0.02)/2=0.1 mol
=> số mol HCl dùng làm môi trường= nKCl+ 2nMnCl2=0.02+0.04=0.06 mol
=> Đáp án B