Ngâm một lá kim loại có khối lượng 50g trong dung dịch HCl. Sau khi thu được 336ml khí H2 (đktc) thì khối lượng lá kim loại giảm 1,68%. Kim loại đó là kim loại nào?
A. Zn
B. Fe
C. Al
D. Ni
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Gọi số mol Fe, Mg là a, b (mol)
=> 56a + 24b = 1,04 (1)
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
a--->2a-------------->a
Mg + 2HCl --> MgCl2 + H2
b---->2b------------->b
=> a + b = 0,03 (2)
(1)(2) => a = 0,01 (mol); b = 0,02 (mol)
mFe = 0,01.56 = 0,56 (g)
mMg = 0,02.24 = 0,48 (g)
b) nHCl(lý thuyết) = 2a + 2b = 0,06 (mol)
=> \(n_{HCl\left(tt\right)}=\dfrac{0,06.110}{100}=0,066\left(mol\right)\)
=> \(V_{dd.HCl\left(tt\right)}=\dfrac{0,066}{0,1}=0,66\left(l\right)\)

Fe+2HCl->Fecl2+H2
x-----2x-----------------x
Mg+2Hcl->MgCl2+h2
y-------2y----------------y
a)
ta có :\(\left\{{}\begin{matrix}56x+24y=10,2\\x+y=0,35\end{matrix}\right.\)
=>x=0,05625 , y=0,29375
=>m Fe=0,05625.56=3,15g
=>m Mg=7,05g
=>VHCl=\(\dfrac{0,05625.2+0,29375.2}{0,1}\)=7l=7000ml

Đáp án A
Ta có: mFe = 40%.m = 0,4m (g) → mCu = m - 0,4m = 0,6m (g)
Sau phản ứng còn 0,65m (g) kim loại > mCu = 0,6m (g)
Khối lượng Fe còn dư: 0,65m - 0,6m = 0,05m (g)
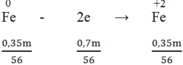
Vậy: mFe phản ứng = 0,4m - 0,05m = 0,35m (g)
Do Fe còn dư sau phản ứng nên tạo thành muối Fe2+
Quá trình nhường electron:
Quá trình nhận electron:
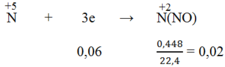
Áp dụng định luật bảo toàn electron, ta có:
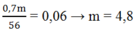
Ta có:
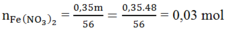
![]()

Mg + 2HCl = MgCl2 +H2
x x
2Al + 6HCl= 2AlCl3 + 3H2
y y
2Cu + O2 = 2CuO
z z = 8/80 = 0,1 mol
3NaOH + AlCl3 = Al(OH)3 + 3NaCL
y y
Al(OH)3 + NaOH = NaALO2 + 2H2O
y y
2NaOH + MgCl2 = Mg(OH)2 + 2NaCl
x x
Mg(OH)2 = MgO + H2O
x x = 4/40 = 0,1 mol
=>mCu= 0,1*64=6,4
mMg=0,1*24=2,4
mAl=10-6,4-2,4=1,2
Đáp án B
Khối lượng kim loại phản ứng là:
Số mol H2 là:
2M + 2nHCl → 2MCln + nH2
Số mol của M là:
⇒ M = 28n ⇒ n = 2, M = 56 ⇒ M: Fe