Khí cacbon monooxit (CO) có lẫn các tạp chất là khí cacbon đioxit ( CO 2 ) và lưu huỳnh đioxit ( SO 2 ) Làm thế nào tách được những tạp chất ra khỏi CO ? Viết các phương trình hoá học.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn B
Dẫn hỗn hợp khí qua dung dịch bazơ dư, các tạp chất là oxit axit bị giữ lại. Khí đi ra khỏi dung dịch là CO (oxit trung tính không tác dụng với bazơ)
PTHH:


Dẫn hỗn hợp khí đi qua dung dịch Ca(OH)2 dư, toàn bộ SO2 và CO2 bị hấp thụ hết do có phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
SO2 + Ca(OH)2 → CaSO3 + H2O
Khí CO không phản ưng, thoát ra và được thu lấy.
Cho hỗn hợp trên tác dụng với nước vôi trong Ca(OH)2.SO2,CO2 bị giữ lại(kết tủa trắng ), khí không phản ứng với Ca(OH)2 là CO thoát ra ngoài.Thu lấy được khí CO tinh khiết.
PTHH : SO2+ Ca(OH)2----> CaSO3 + H2O
CO2 + Ca(OH)2 ----> CaCO3 + H2O
Chúc em học tốt!!

Khí CO thường được dùng làm chất đốt trong công nghiệp. Một loại khí CO có lẫn tạp chất CO₂, SO₂. Hoá chất nào sau đây có thể loại bỏ những tạp chất trên ra khỏi CO? *
H₂O cất.
dung dịch HCl.
dung dịch NaCl.
dung dịch NaOH.
HCl có tên gọi là *
axit clohidric.
axit sunfuric.
axit cloric.
axit hidroclorua.
Dãy các chất thuộc loại axit là *
H₃PO₄, H₂S.
Na₂SO₄, H₂SO₄.
HNO₃, K₂S.
NaCl, H₂SO₄.
Chất nào sau đây tác dụng với dung dịch axit sunfuric loãng? *
Fe₂O₃.
CO.
P₂O₅.
SO₃.
Cho các chất: Ca, CaO, CaCO₃, CaCl₂. Chất tác dụng với dung dịch axit clohiđric tạo chất khí có thể làm vẩn đục dung dịch nước vôi trong là *
CaCO₃.
CaO.
CaCl₂.
Ca.

- Dẫn hh khí qua dd Ca(OH)2 dư, khí thoát ra là C2H2 tinh khiết
Ca(OH)2 + CO2 --> CaCO3 + H2O

Để loại bỏ SO2 và CO2 ta dùng dung dịch bazơ. Dung dịch bazơ rẻ tiền nhất là dung dịch nước vôi trong Ca(OH)2. Dẫn hỗn hợp khí đi qua dung dịch Ca(OH)2 dư, toàn bộ SO2 và CO2 bị hấp thụ hết do có phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
SO2 + Ca(OH)2 → CaSO3 + H2O
Khí CO không phản ưng, thoát ra và được thu lấy.

a) $CaCO_3 \xrightarrow{t^o} CaO + CO_2$
b) $m_{CaCO_3} = 120 - 120.20\% = 96(gam)$
Theo PTHH :
$n_{CaO} = n_{CaCO_3} = \dfrac{96}{100} = 0,96(mol)$
$\Rightarrow m_{CaO} = 0,96.56 = 53,76(gam)$
c) $n_{CO_2} = n_{CaCO_3} = 0,96(mol)$
$\Rightarrow V_{CO_2} = 0,96.22,4 = 21,504(lít)$

a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Theo phương trình 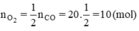
c) Hoàn chỉnh bảng
Thời điểm t1 nCO còn 15mol ⇒ nCO đã phản ứng = 20 - 15= 5mol
Theo pt nCO2 = nCO(pư) = 5 mol
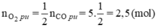 ⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
Tương tự tính thời điểm t2 và thời điểm t3 ta được số liệu sau:
| Số mol | |||
| Các thời điểm | Các chất phản ứng | Sản phẩm | |
| CO | O2 | CO2 | |
| Thời điểm ban đầu t0 | 20 | 10 | 0 |
| Thời điểm t1 | 15 | 7,5 | 5 |
| Thời điểm t2 | 3 | 1,5 | 17 |
| Thời điểm kết thúc t3 | 0 | 0 | 20 |

Đáp án C
Sử dụng dung dịch C a O H 2 d ư . S O 2 v à C O 2 phản ứng bị giữ lại, còn CO không phản ứng thoát ra khỏi dung dịch thu được CO tinh khiết.
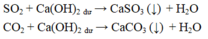
Dẫn hỗn hợp khí qua dung dịch bazơ dư, các tạp chất là oxit axit bị giữ lại. Đi ra khỏi dung dịch là khí CO (oxit trung tính không tác dụng với bazơ).
Phương trình phản ứng
CO 2 + Ca OH 2 → CaCO 3 + H 2 O
SO 2 + Ca OH 2 → CaSO 3 + H 2 O