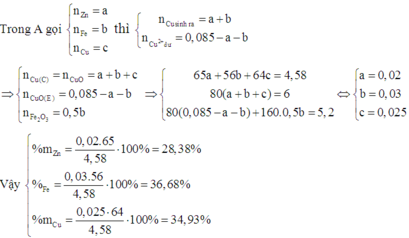Cho 6,8 gam hỗn hợp X gồm Zn và Fe vào 325ml dung dịch CuSO4 0,2M, sau phản ứng hoàn toàn, thu được dung dịch và 6,96 gam hỗn hợp kim loại Y. Khối lượng Fe bị oxi hóa bởi icon Cu2+ là:
A. 1,4 gam.
B. 4,2 gam.
C. 2,1 gam.
D. 2,8 gam.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Δm = 6,96 – 6,8 = 0,16g
Zn + Cua2+ → Zn2+ + Cu
x
Fe + Cu2+ → Zn2+ + Cu
y
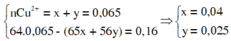
→ mFe bị oxi hóa = 0,025.56 = 1,4g
Đáp án A

nCu=0.21 nMg=a,nFe=b
24a+56b=9.2
a*(64-24)+(0.21-a)*(064-56)=15.68-9.2 nên a=0.15 b=0.1
%fe=60.8%
Đáp án A

Đáp án A
Các phản ứng có thể xảy ra:
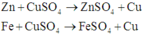
Trong 3 kim loại Zn, Fe và Cu thì Fe có khối lượng mol nhỏ nhất
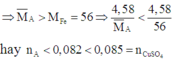
Do đó B chứa Cu2+ dư
Khi đó C chứa Cu trong A và Cu sinh ra sau phản ứng. Nên D chứa CuO.
B chứa Zn2+, Fe2+ và Cu2+ dư. Khi cho B tác dụng với dung dịch NaOH dư thì kết tủa thu được chứa Fe(OH)2 và Cu(OH)2 .
Do đó E chứa Fe2O3 và CuO.