Hoà tan hoàn toàn hỗn hợp 2 kim loại kiềm vào nước thu được 0,448 lít khí H2 (đktc) và 400ml dung dịch X. Giá trị pH của dung dịch X là:
A. 1.
B. 2.
C. 12.
D. 13.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
n OH - = 2 n H 2 = 0 , 48 ⇒ 1 2 dung dịch C có n OH - = 0 , 48 2 = 0 , 24
Dung dịch D có: n H + = 2 n H 2 SO 4 + n HCl = 2 a + 4 a = 6 a
Vì trung hòa 1/2 dung dịch C bằng dung dịch D nên 6a=0,24 óa=0,04
Vậy m = m kl + m SO 4 2 - + m Cl -
= 1 2 m X + 96 a + 35 , 5 . 4 a = 18 , 46 ( gam )

\(n_{OH^-}=2n_{H_2}=2\cdot\dfrac{0.448}{22.4}=0.04\left(mol\right)\)
\(n_{HCl}=0.02\left(mol\right)\)
\(OH^-+H^+\rightarrow H_2O\)
\(n_{OH^-\left(dư\right)}=0.04-0.02=0.02\left(mol\right)\)
\(\left[OH^-\right]_{dư}=\dfrac{0.02}{0.2}=0.1\left(M\right)\)
\(pH=14+\log\left[OH^-\right]=14+\log\left[0.1\right]=13.\)

đáp án B
Ta có nH2=0.24 nên nOH-=0.48 toàn bộ OH- phản ứng với H+ được thay bằng các gốc axit tạo muối nên nH+ của H2SO4=2/(2+4) *0.24=0.08
nên nSO4=0.04,n Cl=0.16
=> m muôi=17.88+0.04*96+0.16*35.5=27.4

Chọn B.
Hỗn hợp 5,8 gam có M (a mol) và M2Ox (b mol) Þ Ma + (2M + 16x).b = 5,8 (1)
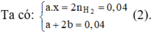
Với x = 1 hoặc 2 thay vào (1), (2) suy ra M = 137 (Ba)

Đáp án C
Theo 4 đáp án thì B là Ba hoặc Ca.
Thử đáp án với B lần lượt là Ba và Ca, ta được đáp án đúng là C.
Đáp án D
Vậy pH = 14 +log (0,1) = 13