Nhỏ từ từ dung dịch Ba(OH)2 vào dung dịch hỗn hợp Al2(SO4)3 và AlCl3 thu được số mol kết tủa theo số mol Ba(OH)2 như sau:
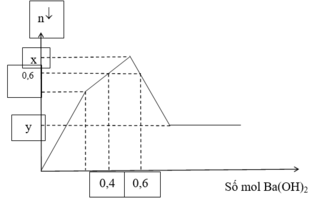
Tổng giá trị của x + y là
A. 0,9.
B. 1,2.
C. 1.
D. 1,1.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Tại điểm 0,6 mol Ba(OH)2: Al(OH)3 tan hết
![]()
Tại điểm H kết tủa Al(OH)3 đạt cực đại nên ![]()
Tại điểm 0,3 mol Ba(OH)2 thì n S O 4 2 - hết nên n S O 4 2 - = 0,3 mol
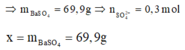
![]()
= 93,3 g
x+ y = 163,2 g

Đáp án B
Nhận thấy tại thời điểm 0,3 mol thì Ba(OH)2 kết tủa vừa đủ với Al2(SO4)3
Khi đó kết tủa gồm BaSO4 : 0,3 mol và Al(OH)3 : 0,2 mol
→ nAl2SO4 = 0,3 : 3= 0,1 mol
Tại thời điểm 0,6 mol Ba(OH)2 thì kết tủa chỉ còn BaSO4 : 0,1 mol, toàn bộ lượng Al(OH)3 bị hòa tan hết → x = 0,3. 233= 69,9 gam
→ 4∑nAl3+ = nOH- = 0,6.2 = 1,2 → ∑nAl3+ = 0,3 mol
Vậy kết tủa cực đại gồm BaSO4 : 0,3 mol và Al(OH)3 : 0,3 mol
→ y = 0,3. 233+ 0,3. 78= 93,3 gam
→ x+ y = 69,9 + 93,3 = 163,2 gam

Đáp án B
Tại điểm 0,6 mol Ba(OH)2: Al(OH)3 tan hết
![]()
Tại điểm H kết tủa Al(OH)3 đạt cực đại nên
![]()
Tại điểm 0,3 mol Ba(OH)2 thì S O 4 2 - hết nên n S O 4 2 - = 0 , 3 m o l
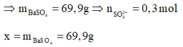
![]()
= 69,9 + 78.0,3 = 93,3 g
x+ y = 163,2 g
Đáp án C.
Định hướng tư duy giải