Đốt 13g bột một kim loại hóa trị II trong oxi dư đến khối lượng không đổi thu được chất rắn X có khối lượng 16,2g (giả sử hiệu suất phản ứng là 100%). Kim loại đó là:
A. Cu
B. Zn
C. Fe
D. Ca
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

gọi kim loại đó là A
2A + O2 ==> 2AO
0,2<==0,1
ta có :
mO2= 16,2-13= 3,2 g
=> nO2= 3,2/32= 0,1 mol
MA= 13/0,2=65 g
=> A là kẽm (Zn)

PTHH: R+O--->RO
Theo đb: 13g 16,2g
Theo PT: R R+16
Ta có: 13(R+16)=16,2R
⇔13R+208=16,2R
⇔3,2R=2008
⇔R=65
Vậy kim loại R là Zn

Đáp án A
Các phản ứng có thể xảy ra:
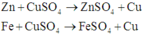
Trong 3 kim loại Zn, Fe và Cu thì Fe có khối lượng mol nhỏ nhất
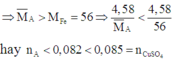
Do đó B chứa Cu2+ dư
Khi đó C chứa Cu trong A và Cu sinh ra sau phản ứng. Nên D chứa CuO.
B chứa Zn2+, Fe2+ và Cu2+ dư. Khi cho B tác dụng với dung dịch NaOH dư thì kết tủa thu được chứa Fe(OH)2 và Cu(OH)2 .
Do đó E chứa Fe2O3 và CuO.
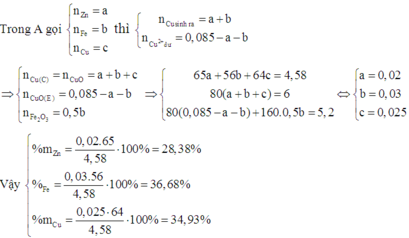
Đáp án B.
Gọi kim loại là R.
Bảo toàn khối lượng:
mO = 16,2 - 13 = 3,2
=> nO2= 0,1 (mol)
2R + O2→ 2RO
0,2 0,1
MR = 65(Zn)