Từ 6,72 lít khí NH3 (ở đktc) thì thu được bao nhiêu lít dung dịch HNO3 3M? Biết hiệu suất của cả quá trình là 80%:
A. 0,3 lít
B. 0,33 lít
C. 0,08 lít
D. 3,3 lít
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Các phương trình điều chế HNO3 từ NH3
4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
2NO + O2→2NO2
4NO2 + O2 + 2H2O→ 4HNO3
Theo bảo toàn nguyên tố N ta có:
nHNO3=nNH3=112 000/22,4=5000 mol
→mHNO3=315 000 gam= 315 kg
→ mddHNO3= 315.100/60=525 kg
Do hiệu suất bằng 80% nên mddHNO3 thực = mPT.80/100= 525.80/100=420 kg

CuO + H2 \(-^{t^o}\rightarrow\) Cu + H2O (1)
3Cu + 8HNO3 \(\rightarrow\) 3Cu(NO3)2 + 2NO + 4H2O (2)
CuO + 2HNO3 \(\rightarrow\) Cu(NO3)2 + 2NO + 4H2O (3)
Ta có : nNO = 0,2 mol.
Theo (2) :\( n_{Cu}=\frac{3}{2}n_{NO}=0,3\) mol ; \(n_{HNO_{3}}=\frac{8}{3}n_{NO}=0,8 (mol).\)
Theo (3) : \(n_{CuO}=\frac{1}{2}n_{HNO_{3}}=\frac{1}{2}(1-0,8)=0,1(mol).\)
=> nCuO ban đầu = 0,1 + 0,3 = 0,4 (mol)
Hiệu suất của quá trình khử CuO là :\( H = \frac{0,3}{0,4}.100=75%.\)
=> Chọn B.

Đáp án B
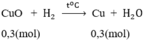
Số mol HNO3: nHNO3 = 1. 1 = 1(mol)
Số mol NO: 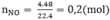
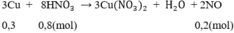
Theo pt: nHNO3 = 4. nNO = 4. 0,2 = 0,8 mol
nHNO3 còn lại = 1 – 0,8 = 0,2 (mol)
⇒ CuO dư phản ứng với HNO3
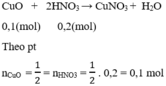
⇒ Tổng nCuO = 0,1 + 0,3 = 0,4 mol
Ban đầu 0,4 mol CuO, phản ứng 0,3 mol CuO
Hiệu suất 

a. PTHH: \(KMnO_4\rightarrow^{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
b. \(H=100\%\)
\(n_{KMnO_4}=\frac{3,6}{158}=0,023mol\)
Theo phương trình \(n_{O_2}=0,5n_{KMnO_4}=0,046mol\)
\(\rightarrow V_{O_2}=0,0115.22,4.100\%=0,2576l\)
c. H = 80%
\(\rightarrow V_{O_2}=0,0115.22,4.80\%=0,20608l\)
Chọn đáp án C