Cho 8,7 gam MnO2 tác dụng với dung dịch axit HCl đậm đặc sinh ra V lít khí Cl2 (đktc). Hiệu suất phản ứng là 85%. V có giá trị là :
A. 2 lít
B. 2,905 lít
C. 1,904 lít
D. 1,82 lít
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo bảo toàn e + đề bài ta có :
\(3x=0,15.2;2y=0,3\)
Với x, y lần lượt là số mol của Al và Cu)
=> x = 0,1 ; y = 0,15 ; => m = 0,1.27 + 0,15.64 = 12,3
Vì Cu đứng sau H trong dãy hoạt động nên ko đẩy đc H khỏi axit nên Cu ko tác tác dụng với HCl nhưng Al thì có(vậy h2 thoát ra là của Al pư)
nH2=3.36/22.4=0.15mol
PTHH: 2Al + 6HCl ---> 2AlCl3 + 3H2
0.1 0.15
m=n*M=>0.1*27=2.7g (1)
Ta biết Al,Fe,Cr thụ động với h2so4 và HNO3 đặc nguội nên trong X chỉ có Cu pư:
nNO2=V*22.4=>6.72/22.4=0.3 mol
PTHH: Cu +4 HNO3 -> Cu(NO3)2 + 2NO2 + 2H2O
0.15 0.3
mCu=0.15*64=9.6g (2)
Từ (1),(2) =>m X =2.7+9.6=12.3g
OH dear,giải xong mệt quá zzzzzzz, chúc em học tốt

- PT: a, \(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\) (1)
\(MnO_2+4HCl_đ\underrightarrow{t^o}MnCl_2+Cl_2+2H_2O\) (2)
- Ta có: \(n_{HCl\left(1\right)}=n_{HCl\left(2\right)}=0,2.2=0,4\left(mol\right)\)
Theo PT (1): \(n_{Cl_2}=\dfrac{5}{16}n_{HCl\left(1\right)}=0,125\left(mol\right)\Rightarrow V_1=0,125.22,4=2,8\left(l\right)\)
(2): \(n_{Cl_2\left(2\right)}=\dfrac{1}{4}n_{HCl\left(2\right)}=0,1\left(mol\right)\Rightarrow V_2=0,1.22,4=2,24\left(l\right)\)

Đáp án D
Số mol KMnO 4 là
![]()
Sơ đồ phản ứng:
K Mn + 7 O 4 ⏟ 0 , 3 mol + H Cl - 1 → Mn + 2 Cl 2 + Cl 2 ⏟ V lit 0 + KCl + H 2 O
Các quá trình nhường, nhận electron:
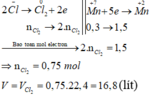

Đáp án B
![]() = 0,15(mol)
= 0,15(mol)
2KMnO4 + 16HCl → 5Cl2 + 8H2O + 2KCl + 2MnCl2
0,15 →0,375 (mol)
![]() = 0,375.22,4 = 8,4(l)
= 0,375.22,4 = 8,4(l)
Đáp án C
MnO2 + 4HCl →MnCl2 + 2H2O + Cl2
0,1 →0,1 (mol)
Do H% = 85% =>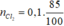 = 0,085 (mol)
= 0,085 (mol)
V = 0,085.22,4 = 1,904 (lít)