Cho 4,05 gam Al tác dụng với dung dịch H2SO4 loãng dư thu được V lít khí H2 ở đktc. Giá trị của V là
A. 2,24
B. 3,36
C. 4,05
D. 5,04
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Phương pháp: Bảo toàn e
Hướng dẫn giải: Bảo toàn e ta có: 3nAl = 2nH2 => nH2 = 1,5nAl = 1,5.(4,05/27) = 0,225 mol
=> V = 0,225.22.4 = 5,04 lít

`n_(H_2)=V/(22,4)=(3,36)/(22,4)=0,15(mol)`
\(PTHH:2Al+3H_2SO_4->Al_2\left(SO_4\right)_3+3H_2\)
tỉ lệ 2 ; 3 ; 1 ; 3
n(mol) 0,1<-------------------------------------0,15
`m_(Al)=n*M=0,1*27=2,7(g)`
`=>B`

Các PTHH :
2Al + 3 H 2 SO 4 → Al 2 SO 4 3 + 3 H 2 (1)
2Al + 6 H 2 SO 4 → Al 2 SO 4 3 + 3 SO 2 + 6 H 2 O (2)
Cu + 2 H 2 SO 4 → Cu SO 4 + 2 H 2 O + SO 2 (3)
Theo PTHH (1) số mol Al tham gia phản ứng bằng 2/3 số mol H 2 => Khối lượng AI trong hỗn hợp : 2×2/3×0,06×27 = 2,16(g)
Số mol SO 2 được giải phóng bởi Al: 2,16/27 x 3/2 = 0,12 mol
Theo PTHH (2) và (3) số mol SO 2 giải phóng bởi Cu : 2.0,1 - 0,12 = 0,08 (mol)
Theo PTHH (3) khối lượng Cu trong hỗn hợp : 0,08. 64 = 5,12 (g)
Vậy m = 2,16 + 5,12 = 7,28 (g).

Đáp án B
Xét giai đoạn m gam Fe tác dụng với dung dịch H2SO4 loãng:
Sơ đồ phản ứng :
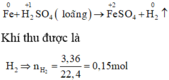
Các quá trình nhường, nhận electron :
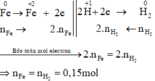
Xét giai đoạn m gam Fe tác dụng với H2SO4 đặc, nóng , dư:
Sơ đồ phản ứng:
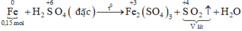
Các quá trình nhường, nhận electron:
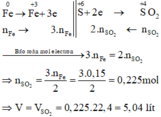
Chọn đáp án D.
V = (4,05/27) ×1,5 × 22,4 = 5,04