Hòa tan hết một lượng S và 0,01 mol Cu2S trong dung dịch HNO3 đặc, nóng, sau phản ứng hoàn toàn dung dịch thu được chỉ có 1 chất tan và sản phẩm khử là khí NO2 duy nhất. Hấp thụ hết lượng NO2 này vào 200ml dung dịch NaOH 1M, rồi cô cạn dung dịch sau phản ứng thì được m gam chất rắn khan. Giá trị của m là
A. 18,4
B. 12,64.
C. 13,92
D. 15,2

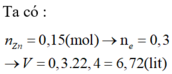




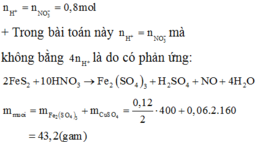


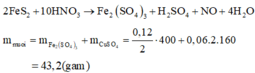
Dễ dàng thấy chất tan là CuSO4 = 0,02 mol (bảo toàn nguyên tố Cu)
=> Quy đổi ban đầu có 0,02 mol S (bảo toàn nguyên tố S) và 0,02 mol Cu
Bảo toàn e => n NO2 = 0,02.6 + 0,02.2 = 0,16 mol
QT cho e :
Cu → Cu2++ 2e
0,02 0,04 mol
S0 → SO42-+ 6e
0,02 0,12 mol
Số mol e cho là ne cho= 0,16 mol
Theo bảo toàn e : ne cho= ne nhận= 0,16 mol
QT nhận e :
N+5+ 1e → NO2
0,16 → 0,16 mol
2NaOH + 2NO2 => NaNO2 + NaNO3 + H2O
Do 0,2> 0,16 nên NO2 hết và NaOH dư
Vì NO2 hết nên n H2O = 0,08 mol (= ½ n NO2)
=> m chất rắn = mNO2+ mNaOH- mH2O= 40.0,2 + 0,16.46 – 0,08.18 = 13,92 gam
Đáp án C