Cho các ion: N a + ; A l 3 + ; S O 4 2 - ; N O 3 - ; C a 2 + ; N H 4 + ; C l - . Hỏi có bao nhiêu cation ?
A. 2.
B. 3.
C. 4.
D. 5.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

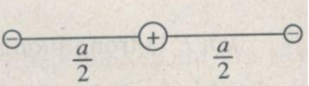
Trong trạng thái cân bằng, những lực điện tác dụng lên mỗi ion cân bằng lẫn nhau. Điều đó có nghĩa là tất cả các lực phải có cùng một giá hay ba ion phải nằm trên cùng một đường thẳng. Mặt khác, hai ion âm phải nằm đối xứng với nhau ở hai bên ion dương (Hình 1.2 G), thì lực điện do chúng tác dụng lên ion dương mới có thể cân bằng nhau.

Trong từ trường đều B, ion C2H5O+ (m1 = 45đvC) chuyển động tròn với bán kính R1.
Ta có: 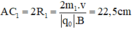
- Đối với ion C2H5OH (m2 = 46đvC)
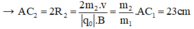
- Đối với ion C2H5+ (m3 = 29đvC)
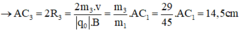
- Đối với ion OH+ (m4 = 17đvC)
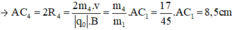
- Đối với ion CH2OH+ (m5 = 31đvC)
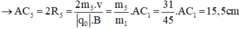
- Đối với ion CH3+ (m6 = 15đvC)
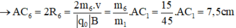
- Đối với ion CH2+ (m7 = 14đvC)
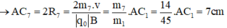

B
Ion F e 2 + có cấu hình electron 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 6 , có phân lớp electron ngoài cùng chưa bão hòa. Tất cả cá ion còn lại đều có các phân lớp electron đã bão hòa

1/ Quá trình nhường - nhận electron.
\(Na^0\rightarrow Na^++e\)
\(Mg^0\rightarrow Mg^{2+}+2e\)
\(Ca^0\rightarrow Ca^{2+}+2e\)
\(F^0+e\rightarrow F^-\)
\(Cl^0+e\rightarrow Cl^-\)
\(O^0+2e\rightarrow O^{2-}\)
\(N^0+3e\rightarrow N^{3-}\)
\(S^0+2e\rightarrow S^{2-}\)
2/ Sự hình thành liên kết ion.
- Trong NaF:
+ Nguyên tử Na nhường 1e.
+ Nguyên tử F nhận 1e.
+ Nguyên tử Na và F tích điện trái dấu nên chúng hút nhau tạo thành phân tử NaF.
- Na2O, MgO, MgF2 giải thích tương tự.
3/ Đặc điểm của các hợp chất ion:
- Các hợp chất ion hầu hết là thể rắn ở nhiệt độ thường, khó tan chảy, khó bay hơi. Chẳng hạn, nhiệt độ nóng chảy của NaCl là 801 oC, nhiệt độ sôi của NaCl là 1465 oC.
- Khi các hợp chất này nóng chảy, hoặc hoà tan trong nước, lực hút tĩnh điện giữa các ion này yếu đi, kết quả là chúng phân li ra các ion trần, nên chúng dẫn điện tốt.
- Ở trạng thái rắn, các hợp chất ion không dẫn được điện.

- \(Li_x^ + F_y^ - \): (+1).x + (-1).y = 0
=> x = y = 1
=> Công thức: LiF
- \(Li_x^ + O_y^{2 - }\): (+1).x + (-2).y = 0
=> x = 2, y = 1
=> Công thức: Li2O
- \(Li_x^ + (P{O_4})_y^{3 - }\): (+1).x + (-3).y = 0
=> x = 3, y = 1
=> Công thức: Li3PO4
- \(Ca_x^{2 + }F_y^ - \): (+2).x + (-1).y = 0
=> x =1, y = 2
=> Công thức: CaF2
- \(Ca_x^{2 + }O_y^{2 - }\): (+2).x + (-2).y = 0
=> x = y = 1
=> Công thức: CaO
- \(Ca_x^{2 + }(P{O_4})_y^{3 - }\): (+2).x + (-3).y = 0
=> x = 3, y = 2
=> Công thức: Ca3(PO4)2
- \(Al_x^{3 + }F_y^ - \): (+3).x + (-1).y = 0
=> x = 1, y = 3
=> Công thức: AlF3
- \(Al_x^{3 + }O_y^{2 - }\): (+3).x + (-2).y = 0
=> x = 2, y = 3
=> Công thức: Al2O3
- \(Al_x^{3 + }(P{O_4})_y^{3 - }\): (+3).x + (-3).y = 0
=> x = y = 1
=> Công thức: AlPO4
Chọn C
Cation là phần tử mang điện dương, các cation lần lượt là: Na+, Ca2+, Al3+