Cho 6,5g kẽm vào bình dung dịch chứa 0,25mol axit clohidric. Sau phản ứng còn dư chất nào? Khối lượng là bao nhiêu gam?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,25}{2}\) => Zn hết, HCl dư
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,1--->0,2------------>0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
b) mHCl(dư) = (0,25 - 0,2).36,5 = 1,825 (g)

Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
nZn = \(\dfrac{6,5}{65}=0,1mol\)
nHCl = \(\dfrac{60.7,3\%}{36,5}=0,12mol\)
Lập tỉ lệ: nZn : nHCl = \(\dfrac{0,1}{1}:\dfrac{0,12}{2}=0,1:0,06\)
=> Zn dư
nZn dư = 0,1 - 0,06 = 0,04 mol
=> mZn dư = 0,04 . 65 = 2,6g
\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(n_{HCl}=\dfrac{60\cdot7.3}{100\cdot36.5}=0.12\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(1...........2\)
\(0.1.........0.12\)
\(LTL:\dfrac{0.1}{1}>\dfrac{0.12}{2}\Rightarrow Zndư\)
\(n_{H_2}=\dfrac{0.12}{2}=0.06\left(mol\right)\)
\(V_{H_2}=0.06\cdot22.4=1.344\left(l\right)\)
\(m_{Zn\left(dư\right)}=\left(0.1-0.06\right)\cdot65=2.6\left(g\right)\)

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\n_{HCl}=0,25\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,25}{2}\) \(\Rightarrow\) HCl còn dư, Kẽm p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,1\left(mol\right)\\n_{HCl\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=22,4\cdot0,1=2,24\left(l\right)\\m_{HCl\left(dư\right)}=0,05\cdot36,5=1,825\left(g\right)\end{matrix}\right.\)

nZn=0,1 mol
nHCl=0,25 mol
Zn +2HCl=>ZnCl2+H2
Pứ 0,1 mol>=0,2 mol. =>0,1 mol
Dư 0,05 mol
VH2=2,24lit
HCl còn dư:0,05 mol
=>mHCl dư=1,825g

\(a,Zn+2HCl\to ZnCl_2+H_2\\ b,n_{Zn}=\dfrac{13}{65}=0,2(mol);n_{HCl}=\dfrac{21,9}{36,5}=0,6(mol)\)
Vì \(\dfrac{n_{Zn}}{1}<\dfrac{n_{HCl}}{2}\) nên \(HCl\) dư
\(n_{HCl(dư)}=0,6-0,2.2=0,2(mol)\\ c,n_{ZnCl_2}=n_{H_2}=n_{Zn}=0,2(mol)\\ \Rightarrow m_{ZnCl_2}=0,2.136=27,2(g)\\ V_{H_2}=0,2.22,4=4,48(l)\)

a)\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(m\right)\)
\(n_{Fe_2O_3}=\dfrac{48}{160}=0,3\left(m\right)\)
\(PTHH:Fe_2O_3+3H_2\underrightarrow{ }2Fe+3H_2O\)
ta có tỉ lệ:\(\dfrac{0,45}{3}< \dfrac{0,3}{1}->H_2dư\)
H2 còn lại sau phản ứng
\(n_{H_2\left(dư\right)}=0,3-0,15=0,15\left(m\right)\)
\(m_{H_2\left(dư\right)}=0,15.2=0,3\left(g\right)\)
b)\(PTHH:Zn+2HCl\underrightarrow{ }ZnCl_2+H_2\)
tỉ lệ :1 2 1 1
số mol :0,15 0,3 0,15 0,15
\(m_{Zn}=0,15.65=9,75\left(g\right)\)

Pt: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{Zn}=\dfrac{3,25}{65}=0,05mol\)
\(n_{HCl}=\dfrac{43,8}{36,5}=1,2mol\)
Lập tỉ lệ:
nZn : nHCl = \(\dfrac{0,05}{1}:\dfrac{1,2}{2}=0,05:0,6\)
=> HCl dư
nHCl dư = 1,2 - 0,05 = 1,15 mol
mHCl dư = 1,15 . 36,5 = 41,975g
b) Theo pt: nH2 = nZn = 0,05 mol
=> VH2 = 0,05.22,4=1,12lit
đề có sai chỗ 43,8 g HCl ko, số hơi to
\(a) n_{Zn} = \dfrac{3,25}{65} = 0,05(mol)\ ; n_{HCl} = \dfrac{43,8}{36,5} = 1,2(mol)\\ Zn + 2HCl \to ZnCl_2 + H_2\\ n_{HCl} = 1,2 > 2n_{Zn} = 0,1 \to HCl\ dư\\ n_{HCl\ pư} = 2n_{Zn} = 0,1(mol)\\ \Rightarrow m_{HCl\ dư} = 43,8 - 0,1.36,5 = 40,15(gam)\\ c) n_{H_2} = n_{Zn} = 0,05(mol) \Rightarrow V_{H_2} = 0,05.22,4 = 1,12(lít)\)

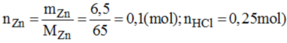
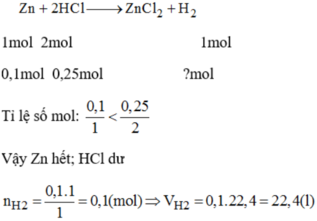
HCl dư: