Tính thành phần phần trăm (theo khối lượng) các nguyên tố hóa học có trong các hợp chất sau: MgO và F e 2 O 3 .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

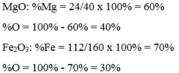

\(M_{KMnO_4}=158(g/mol)\\ \%_{K}=\dfrac{39}{158}.100\%=24,68\%\\ \%_{Mn}=\dfrac{55}{158}.100\%=34,81\%\\ \%_O=100\%-24,68\%-34,81\%=40,51\%\)

\(CaCO_3\\ \%m_{Ca}=\dfrac{40}{40+12+3.16}.100=40\%\\ \%m_C=\dfrac{12}{40+12+16.3}.100=12\%\\ \Rightarrow\%m_O=100\%-\left(40\%+12\%\right)=48\%\\ H_2SO_4\\ \%m_H=\dfrac{2.1}{2.1+32+4.16}.100\approx2,041\%\\ \%m_S=\dfrac{32}{2.1+32+4.16}.100\approx32,653\%\\ \%m_O=\dfrac{4.16}{2.1+32+4.16}.100\approx65,306\%\\ Fe_2O_3\\ \%m_{Fe}=\dfrac{56.2}{56.2+16.3}.100=70\%\\ \Rightarrow\%m_O=100\%-70\%=30\%\)
CaCO3
\(\%M_{\dfrac{Ca}{CaCO_3}}=\dfrac{40}{100}.100\%=40\%\)
\(\%M_{\dfrac{C}{CaCO_3}}=\dfrac{12}{100}.100\%=12\%\)
\(\%M_{\dfrac{O}{CaCO_3}}=100\%-\left(40\%+12\%\right)=48\%\)
H2SO4
\(\%M_{\dfrac{H_2}{H_2SO_4}}=\dfrac{2}{98}.100\%=2,04\%\)
\(\%M_{\dfrac{S}{H_2SO_4}}=\dfrac{32}{98}.100\%=32,65\%\)
\(\%M_{\dfrac{O}{H_2SO_4}}=100\%-\left(2,04\%+32,65\%\right)=65,31\%\)
Fe2O3
\(\%M_{\dfrac{Fe}{Fe_2O_3}}=\dfrac{112}{160}.100\%=70\%\)
\(\%M_{\dfrac{O}{Fe_2O_3}}=100\%-70\%=30\%\)

\(CaO:\%^MCa=\dfrac{40}{40+16}\cdot100\%=71,43\%\\ \%^MO=100\%-71,43\%=28,57\%\)
\(MgCO_3:\%^MMg=\dfrac{24}{24+12+16\cdot3}\cdot100\%=28,57\%\\ \%^MC=\dfrac{12}{24+12+16\cdot3}\cdot100\%=14,29\%\\ \%^MO=100\%-28,57\%-14,29\%=57,14\%\)
\(NaOH:\%^MNa=\dfrac{23}{23+16+1}\cdot100\%=57,5\%\\ \%^MO=\dfrac{16}{23+16+1}\cdot100\%=40\%\\ \%^MH=100\%-57,5\%-40\%=2,5\%\)

Câu 2:
Trong 1 mol X: \(\left\{{}\begin{matrix}n_{Ag}=\dfrac{170.63,53\%}{108}=1\left(mol\right)\\n_N=\dfrac{170.8,23\%}{14}=1\left(mol\right)\\n_O=\dfrac{170\left(100\%-63,53\%-8,23\%\right)}{16}=3\left(mol\right)\end{matrix}\right.\)
Vậy CTHH của X là \(AgNO_3\)
Câu 1:
\(a,\%_{Fe}=\dfrac{56}{180}\cdot100\%=31,11\%\\ \%_N=\dfrac{14\cdot2}{180}\cdot10\%=15,56\%\\ \%_O=100\%-31,11\%-15,56\%=53,33\%\\ b,\%_{N\left(N_2O\right)}=\dfrac{14\cdot2}{44}\cdot100\%=63,63\%\\ \%_{O\left(N_2O\right)}=100\%-63,63\%=36,37\%\\ \%_{N\left(NO\right)}=\dfrac{14}{30}\cdot100\%=46,67\%\\ \%_{O\left(NO\right)}=100\%-46,67\%=53,33\%\\ \%_{O\left(NO_2\right)}=\dfrac{16\cdot2}{46}\cdot100\%=69,57\%\\ \%_{N\left(NO_2\right)}=100\%-69,57\%=30,43\%\)

\(M_{Fe_3O_4}=56.3+16.4=232\left(\dfrac{g}{mol}\right)\)
\(\%Fe=\dfrac{56.3}{232}.100\%=72,4\%\)
\(\%O=\dfrac{16.4}{232}.100\%=27,862\%\)
tìm công thức hóa học của hợp chất có thàn phần các nguyên tố như sau:55,189%K; 14,623%P và còn lại là oxi.Biết 0,05 mol hợp chất có khối lượng là 10,6 gam

\(CT:C_{12}H_{22}O_{11}\)
\(M=12\cdot12+22+11\cdot16=342\left(đvc\right)\)
\(\%C=\dfrac{12\cdot12}{342}\cdot100\%=42.1\%\)
\(\%H=\dfrac{22}{342}\cdot100\%=6.43\%\)
\(\%O=51.47\%\)

\(PTK_{CuO}=64+16=80\left(đvC\right)\)
\(\%m_{Cu}=\) \(\dfrac{64}{80}.100=80\%\)
\(\%m_O=100-80=20\%\)
\(PTK_{MgCO_3}=24+12+3.16=84\left(đvC\right)\)
\(\%m_{Mg}=\dfrac{24}{84}.100=28,57\%\)
\(\%m_C=\dfrac{12}{84}.100=14,28\%\)
\(\%m_O=\dfrac{3.16}{84}.100=57,14\%\)
các ý còn lại làm tương tự

a) Hợp chất CO có MCO = 12 + 16 = 28 g/mol
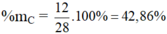
%mO = 100 – 42,86 = 57,14%
Hợp chất CO2: có MCO2 = 12 + 32 = 44 g/mol
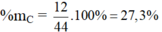
%mO = 100 – 27,3 = 72,7%
b) Hợp chất Fe3O4: MFe3O4 = 3.56 + 4.16 = 232 g/mol
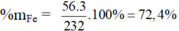
%mO = 100 – 72,4 = 27,6%
Hợp chất Fe2O3: MFe2O3 = 2.56 + 3.16 = 160 g/mol
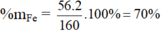
%mO = 100 – 70 = 30%
c) Hợp chất SO2 : MSO2 = 32 + 2.16 = 64 g/mol
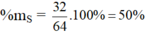
%mO = 100 – 50 = 50%
Hợp chất SO3 : MSO3 = 32 + 16.3 = 80 g/mol
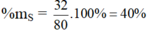
%mO = 100 – 40 = 60%

`a,` \(K.L.P.T_{Fe_2O_3}=56.2+16.3=160< amu>.\)
\(\%Fe=\dfrac{56.2.100}{160}=70\%\)
\(\%O=100\%-70\%=30\%\)
`b,`\(K.L.P.T_{CaCO_3}=40+12+16.3=100< amu>.\)
\(\%Ca=\dfrac{40.100}{100}=40\%\)
\(\%C=\dfrac{12.100}{100}=12\%\)
\(\%O=100\%-40\%-12\%=48\%\)
`c,` \(K.L.P.T_{HCl}=1+35,5=36,5< amu>.\)
\(\%H=\dfrac{1.100}{36,5}\approx2,74\%\)
\(\%Cl=100\%-2,74\%=97,26\%\)
a: \(\%Fe=\dfrac{56\cdot2}{56\cdot2+16\cdot3}=70\%\)
=>%O=30%
b: \(\%Ca=\dfrac{40}{40+12+16\cdot3}=40\%\)
\(\%C=\dfrac{12}{100}=12\%\)
%O=100%-12%-40%=48%
c: %H=1/36,5=2,74%
=>%Cl=97,26%