Đốt cháy hết một phân tử hợp chất A( chưa biết) cần 2 phân tử O 2 . Sau phản ứng thu được 2 phân tử C O 2 và 2 phân tử H 2 O . Công thức hoá học của hợp chất A là:
A. C 2 H 6
B. C 2 H 4
C. C 2 H 4 O
D. C 2 H 4 O 2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 2 :
a)
\(n_{CO_2} = \dfrac{0,3.10^{23}}{6.10^{23}} = 0,05(mol)\\ n_{O_2} = \dfrac{0,9.10^{23}}{6.10^{23}} = 0,15(mol)\)
Vậy :
\(\%n_{CO_2} = \dfrac{0,05}{0,15+0,05}.100\% = 25\%\\ \%n_{O_2} = 100\% - 25\% = 75\%\)
b)
Sục hỗn hợp vào dung dịch Ca(OH)2 lấy dư,thu lấy khí thoát ra ta được O2.Lọc dung dịch,thu lấy kết tủa
\(Ca(OH)_2 + CO_2 \to CaCO_3 + H_2O\)
Cho kết tủa vào dung dịch HCl lấy dư, thu lấy khí thoát ra. Ta thu được khí CO2
\(CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O\)

C2H6O2+2,5 O2-to>2CO2+3H2O
0,1-----------------------0,2--------0,3
n H2O=0,3 mol
=>VCO2=0,2.22,4=4,48l
=>a=mC2H6O2=0,1.62=6,2g
a, PT: \(C_2H_6O_2+\dfrac{5}{2}O_2\underrightarrow{t^o}2CO_2+3H_2O\)
b, Ta có: \(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\)
Theo PT: \(n_{C_2H_6O_2}=\dfrac{1}{3}n_{H_2O}=0,1\left(mol\right)\)
\(\Rightarrow m_{C_2H_6O_2}=0,1.62=6,2\left(g\right)\)
\(n_{CO_2}=\dfrac{2}{3}n_{H_2O}=0,2\left(mol\right)\)
\(\Rightarrow V_{CO_2}=0,2.22,4=4,48\left(l\right)\)
Bạn tham khảo nhé!

Đáp án B
Gọi công thức phân tử của A là CxHyOz.
Sản phẩm cháy sau phản ứng gồm CO2 và H2O
Vì khi cho NaOH dư vào dung dịch X thì thu thêm được 15 gam kết tủa nên trong dung dịch X có chứa muối Ca(HCO3)2 :
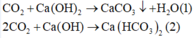
![]()
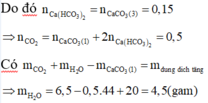
![]()
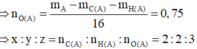
Mà công thức phân tử của A cũng chính là công thức đơn giản nhất nên công thức phân tử của A là C2H2O3.

Bảo toàn C và H: \(n_C=n_{CO_2}=0,2(mol);n_H=2n_{H_2O}=0,6(mol)\)
Do đó \(m_O=4,6-0,2.12-0,6.1=1,6(g)\Rightarrow n_O=0,1(mol)\)
Đặt \(CTPT_Z:C_xH_yO_z\)
\(\Rightarrow x:y:z=0,2:0,6:0,1=2:6:1\\ \Rightarrow CTPT_Z:C_2H_6O\)

a) 4Na + O2 -> 2Na2O ( 1 )
b) chất phản ứng : Na tác dụng với O2
Sản phẩm : Na2O
Điều kiện : nhiệt độ
c) Số nguyên tử Na : Số phân tử O2 : Số phân tử Na2O = 4 : 1 : 2
d) ....
e) nNa = 46 : 23 = 2 mol
Từ pt(1) => nO2 = \(\frac{1}{4}nNa=\frac{1}{4}2=\frac{1}{2}\)=0,5mol
=> mO2 = 0,5 . 32 = 16g

1)
\(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)\)
\(n_{H_2O}=\dfrac{2,7}{18}=0,15\left(mol\right)\)
Bảo toàn C: nC = 0,2 (mol)
Bảo toàn H: nH = 0,3 (mol)
\(\left\{{}\begin{matrix}\%C=\dfrac{0,2.12}{4,3}.100\%=55,81\%\\\%H=\dfrac{0,3.1}{4,3}=6,97\%\\\%O=100\%-55,81\%-6,97\%=37,22\%\end{matrix}\right.\)
2)
\(n_O=\dfrac{4,3-0,2.12-0,3}{16}=0,1\left(mol\right)\)
nC : nH : nO = 0,2 : 0,3 : 0,1 = 2:3:1
=> CTPT: (C2H3O)n
Mà M = 43.2 = 86 (g/mol)
=> n = 2
=> CTPT: C4H6O2
Chọn D