hòa tan hoàn toàn 18 gam al vào axit hno3 loãng. Sau phản ứng giải phóng N2O và No theo tỷ lệ mol là 3:1. HNO3 đã nhận bao nhiêu mol electron
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án B
10HNO3 + 8e → N2O + 8NO3– + 5H2O ||⇒ nHNO3 phản ứng = 10nN2O = 0,15 mol ⇒ chọn B.

đáp án B
10HNO3 + 8e → N2O + 8NO3– + 5H2O ||⇒ nHNO3 phản ứng = 10nN2O = 0,15 mol ⇒ chọn B.

Chọn A
Giả sử sau phản ứng có x mol NH4NO3. Ta có:
Quá trình cho e:
Mg → Mg+2 +2e
Al → Al+3 +3e
Zn → Zn+2 +2e
Quá trình nhận e: N+5 → N+1 - 4e
N+5 → N+2 - 3e
N+5 → N-3 - 8e
DLBT e : 2nMg + 3nAl + 2nZn = 8nN2O + 3nNO + 8nNH4NO3
→ m muối = mKL + mNO3-(muối KL) + mNH4NO3
nNO3- (muối KL)= ne trao đổi
→157,05 = 31,25 + 62(8.0,1+3.0,1+8x) + 80x
x= 0,1 mol → nHNO3 đã bị khử = 2nN2O + nNO +nNH4NO3= 0,4 mol

Khối lượng muối nitrat kim loại = 30 + 0,1 x 8 x 62 + 0,1 x 3 x 62 = 98,2 gam
--> m NH4NO3 = 127 - 98,2 = 28,8 gam
--> n NH4NO3 = 28,8/80 = 0,36 mol
--> n HNO3 bị khử = 2n N2O + n NO + n NH4NO3 = 0,1 x 2 + 0,1 + 0,36 = 0,66 mol.

nAl = nAl(NO3)3 = 3,78/27 = 0,14 mol
mAl(NO3)3 = 0,14.213 = 29,82 g < 31,42
=> m muối bao gồm Al(NO3)3 và NH4NO3
m NH4NO3 = 31,42 - 29,82 = 1,6 g
n NH4NO3 = 1,6/80 = 0,02 mol
bảo toàn điện tích 3nAl = 8nN20 + 3nNO + 8nNH4NO3
=) 8nN20 + 3nNO = 0,26
ta có 6nN2O - nNO = 0
giải hệ trên ta đc \(\left\{{}\begin{matrix}nN2O=0,01mol\\nNO=0,06mol\end{matrix}\right.\)
=> a= 0,01 + 0,06 = 0,07 mol
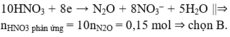

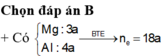
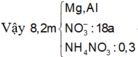

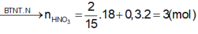

Giả sử: \(\left\{{}\begin{matrix}n_{N_2O}=x\left(mol\right)\\n_{NO}=y\left(mol\right)\end{matrix}\right.\)
Ta có: \(n_{Al}=\frac{2}{3}\left(mol\right)\)
Các quá trình:
\(Al^0\rightarrow Al^{+3}+3e\)
2/3 _________ 2 (mol)
\(2N^{+5}+8e\rightarrow N_2^{+1}\)
x ______ 4x______ (mol)
\(N^{+5}+3e\rightarrow N^{+2}\)
y______3y________ (mol)
Theo ĐLBT mol e, có: 4x + 3y = 2
Mà: 4x + 3y là số mol e mà HNO3 nhận.
Vậy: HNO3 đã nhận 2 mol e.
Bạn tham khảo nhé!