cho hỗn hợp gồm 60% FE2O3 và 40% CuO người ta dùng H2 để khử 20g hỗn hợp đó. tính % khối lượng mỗi kim loại co storng hôn hợp kim loại sau phản ứng
\nHãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


, PTHH :
Fe2O3 + 3H2 -> 2Fe + 3H2O
0,075......0,225.........0,15 (mol)
CuO + H2 -> Cu + H2O
0,1.......0,1......0,1 (mol)
mFe2O3 = 20.60%=12(g) => nFe2O3 = 0,075(mol)
mCuO = 8 ( g) => nCuO = 0,1(mol)
mFe = 0,15 .56=8,4(g)
mCu = 0,1 .64=6,4(g)
=>bạn llàm như ý đướiưới để tính % nhé

hỗn hợp 100% <=> 20g
1. fe2o3 60% <=> 12g <=> 0,075mol
cuo 40% <=> 8g <=> 0,1 mol
Ta có:
Fe2O3 + 3H2 --> 2Fe + 3H2O
mol: 0,075 0,225 0,15
CuO + H2 → Cu + H20
mol: 0.1 0.1 0.1
mFe= 0,15x56=8,4g. mCu=0,1x64= 6,4g
nH2= 0,225+0,1=0,325mol ==> V H2 = 0,325x 22,4 = 7,28 lít

\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\\ CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\\ Đặt:n_{Fe_2O_3}=a\left(mol\right);n_{CuO}=b\left(mol\right)\left(a,b>0\right)\\ m_{hhoxit}=k\left(g\right)\\ \Rightarrow\left(1\right)160a+80b=k\\ \left(2\right)112a+64b=0,72k\\ \Rightarrow6,4a=12,8b\\ \Leftrightarrow\dfrac{a}{b}=\dfrac{12,8}{6,4}=\dfrac{2}{1}\\ \Rightarrow\%m_{Fe_2O_3}=\dfrac{160.2}{160.2+80.1}.100=80\%\\ \Rightarrow\%m_{CuO}=20\%\)

PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
a, Ta có: \(\left\{{}\begin{matrix}m_{Fe_2O_3}=20.60\%=12\left(g\right)\Rightarrow n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\\m_{CuO}=20-12=8\left(g\right)\Rightarrow n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\end{matrix}\right.\)
Theo pT: \(\left\{{}\begin{matrix}n_{Fe}=2n_{Fe_2O_3}=0,15\left(mol\right)\\n_{Cu}=n_{CuO}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)
b, Theo PT: \(n_{H_2}=3n_{Fe_2O_3}+n_{CuO}=0,325\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,325.22,4=7,28\left(l\right)\)
Bạn tham khảo nhé!

1)
Phần trăm O trong oxit là 100% -76% = 24%
$CO + O_{oxit} \to CO_2$
Ta thấy :
m khí tăng = m O(oxit) = 9,6(gam)
=> m1 = 9,6/24% = 40(gam)
n O(oxit) = 9,6/16 = 0,6(mol)
Bảo toàn khối lượng :
m kim loại = m oxit - m O = 40 - 0,6.16 = 30,4(gam)
$Fe + 2HCl \to FeCl_2 + H_2$
n Fe = n H2 = 4,48/22,4 = 0,2(mol)
=> m Cu = m 2 = 30,4 - 0,2.56 = 19,2(gam)
b)
n CuO = n Cu = 19,2/64 = 0,3(mol)
Ta có :
n O(trong oxit sắt) = n O(oxit) - n O(trong CuO) = 0,6 -0,3 = 0,3(mol)
Ta thấy :
n Fe : n O = 0,2 : 0,3 = 2 : 3
Vậy oxit cần tìm là Fe2O3

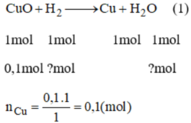
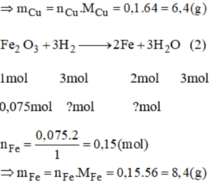
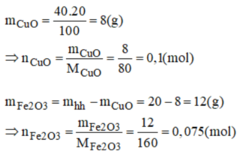



có thể viết lại không ah
\nTa có:
\n\n\\(\\%m_{Fe2O3}=60\\%.20=12\\left(g\\right)\\Rightarrow n_{Fe2O3}=\\frac{12}{160}=0,075\\left(mol\\right)\\)
\n\n\\(\\%m_{CuO}=40\\%.20=8\\left(g\\right)\\Rightarrow n_{CuO}=\\frac{8}{80}=0,1\\left(mol\\right)\\)
\n\n\\(Fe_2O_3+3H_2\\rightarrow2Fe+3H_2O\\)
\n\n_0,075__________0,15_____
\n\n\\(CuO+H_2\\rightarrow Cu+H_2O\\)
\n\n_0,1___________0,1_____
\n\n\\(\\left\\{{}\\begin{matrix}m_{Fe}=0,15.56=8,4\\left(g\\right)\\\\m_{Cu}=0,1.64=6,4\\left(g\\right)\\end{matrix}\\right.\\)
\n\n\\(\\Rightarrow\\left\\{{}\\begin{matrix}\\%m_{Fe}=\\frac{8,4}{8,4+6,4}.100\\%=56,76\\%\\\\\\%m_{Cu}=100\\%-56,76\\%=43,24\\%\\end{matrix}\\right.\\)
\n