A là hỗn hợp gồm H2 và O2 có tỉ khối so với là 8,5. Sau 1 thời gian đốt cháy 4,48 l khí A trong bình kín bằng tia lửa điện rồi làm lạnh người ta thu được a gam nước và b l khí khí B có tỉ khối so với H2 là 10.Hãy xác định giá trị của a,b? Các khí đo ở đktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(\left\{{}\begin{matrix}n_{H_2}+n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\\dfrac{2.n_{H_2}+32.n_{O_2}}{n_{H_2}+n_{O_2}}=8,5.2=17\end{matrix}\right.=>\left\{{}\begin{matrix}n_{H_2}=0,1\\n_{O_2}=0,1\end{matrix}\right.\)
Gọi k là số mol H2 pư
PTHH: 2H2 + O2 --to--> 2H2O
Trc pư: 0,1 0,1 0
Pư: k--->0,5k---------->k
\(\left\{{}\begin{matrix}n_{H_2\left(Saupư\right)}=0,1-k\left(mol\right)\\n_{O_2\left(saupư\right)}=0,1-0,5k\left(mol\right)\\n_{H_2O\left(saupư\right)}=k\left(mol\right)\end{matrix}\right.\)
=> \(\dfrac{2\left(0,1-k\right)+32\left(0,1-0,5k\right)}{\left(0,1-k\right)+\left(0,1-0,5k\right)}=10.2=20\)
=> k = 0,05 (mol)
=> mH2O = 0,05.18 = 0,9(g)
\(\left\{{}\begin{matrix}n_{H_2}\left(saupư\right)=0,1-k=0,05\left(mol\right)\\n_{O_2}\left(saupư\right)=0,1-0,5k=0,075\left(mol\right)\end{matrix}\right.\)
=> \(V_B=\left(0,05+0,075\right).22,4=2,8\left(l\right)\)

a)
\(V_{H_2} = V_{O_2} = \dfrac{4,48}{2} = 2,24(lít)\)
b)
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ V_{H_2} = 2,24 < 2V_{O_2} = 4,48(lít)\)
Do đó, O2 dư.
\(V_{O_2\ pư} = \dfrac{1}{2}V_{H_2} = 1,12(lít)\\ \Rightarrow V_A = V_{O_2\ dư} = 2,24 - 1,12 = 1,12(lít)\)
a, Theo bài ra ta có : \(\left\{{}\begin{matrix}V_{H2}+V_{O2}=4,48\\V_{H2}=V_{O2}\end{matrix}\right.\)
\(\Rightarrow V_{O2}=V_{H2}=2,24\left(l\right)\)
b, Ta có : \(n_{O_2}=n_{H_2}=\dfrac{V}{22,4}=0,1\left(mol\right)\)
\(PTHH:2H_2+O_2\rightarrow2H_2O\)
Thấy sau phản ứng O2 dư .
=> \(V_A=V_{O2du}=22,4\left(n_{o2}-n_{O2pu}\right)=1,12\left(l\right)\)
Vậy ..

Gọi số mol CH4, O2 là a, b (mol)
Có: \(\overline{M}_A=\dfrac{16a+32b}{a+b}=14,4.2=28,8\left(g/mol\right)\)
=> 12,8a = 3,2b
=> a : b = 1 : 4
Giả sử A gồm 1 mol CH4 và 4 mol O2
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
Xét tỉ lệ: \(\dfrac{1}{1}< \dfrac{4}{2}\) => CH4 hết, O2 dư
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
1---->2----------->1
=> \(B\left\{{}\begin{matrix}CO_2:1\left(mol\right)\\O_{2\left(dư\right)}=4-2=2\left(mol\right)\end{matrix}\right.\)
=> \(\overline{M}_B=\dfrac{1.44+2.32}{1+2}=36\left(g/mol\right)\)
=> \(d_{B/A}=\dfrac{36}{28,8}=1,25\)

Đáp án C
Ankin thể khí, do đó số nguyên tử C < 5
Đặt số mol của C2H6: a mol; CnH2n-2: a mol; O2: b mol
Gọi hỗn hợp sau khi đốt là hỗn hợp C ta có:
nB: nC = MC: MB = 21,4665: 18 = 1,2
Chọn: nB = 1,2 mol mB = 18.2.1,2 = 43,2g
Ta có :
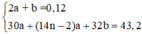
14na – 36a + 32.(2a + b)=43,2g
14na – 36a + 32.1,2 =43,2g
14na – 36a = 4,8 a =
Mà 2a < 12 a < 0,6 hay < 0,6 7n – 18 > 4 n > 3,14
n = 4 ankin là C4H6

Đáp án B
Áp dụng phương pháp đường chéo cho hỗn hợp X:
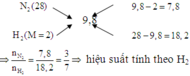
Cách 1: Gọi số mol N2 là 3x thì số mol H2 là 7x ⇒ tổng số mol hỗn hợp X là 3x + 7x = 10x
Thay vào công thức:
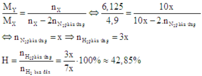
Cách 2: Áp dụng công thức tính nhanh với trường hợp x < 3y:
Hiệu suất phản ứng:
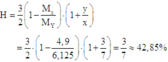

Giả sử các khí được đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
Gọi số mol CH4, C2H6 là a, b (mol)
=> \(a+b=\dfrac{25}{1}=25\left(mol\right)\) (1)
\(n_{O_2}=\dfrac{95}{1}=95\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a---->2a---------->a
2C2H6 + 7O2 --to--> 4CO2 + 6H2O
b------>3,5b-------->2b
=> \(\left\{{}\begin{matrix}n_{O_2\left(dư\right)}=95-2a-3,5b\left(mol\right)\\n_{CO_2}=a+2b\left(mol\right)\end{matrix}\right.\)
=> \(95-a-1,5b=\dfrac{60}{1}=60\)
=> a + 1,5b = 35 (2)
(1)(2) => a = 5; b = 20
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{5}{25}.100\%=20\%\\\%V_{C_2H_6}=\dfrac{20}{25}.100\%=80\%\end{matrix}\right.\)
\(\overline{M}_A=\dfrac{5.16+20.30}{5+20}=27,2\left(g/mol\right)\)
\(\overline{M}_B=20,5.2=41\left(g/mol\right)\)
=> \(d_{A/B}=\dfrac{27,2}{41}\approx0,663\)