Đồng thau là một hợp kim của Cu và Zn. Lấy một mẫu đồng thau chia thành 2 phần bằng nhau.
+ Phần 1: Cho vào h2SO4 dư thu được 1g rắn không tan.
+ Phần 2 Luyện thêm 4g Al vào thu được hỗn hợp B trong đó phần trăm khối lượng của Zn nhỏ hơn 33.3% so với phần trăm khối lượng Zn trong mẫu hỗn hợp ban đầu.
a) Tính thành phần phần trăm Cu trong mẫu đồng thau biết khi ngâm hợp kim B vào NaOH sau 1 thời gian khí bay ra vượt quá 6 lít (đktc)
b) Từ hợp kim B, muốn có hợp kim C chứa thành phần phần trăm về khối lượng của các kim loại tương ứng là 20% Cu, 50% Zn và 30% Al thì phải luyện thêm các kim loại với lượng nhỏ nhất là bao nhiêu gam


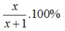
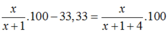







a)
Gọi khối lượng của Zn trong đồng thau là : a(g)
Zn+ H2SO4→ ZnSO4+ H2↑
1(g) chất rắn không tan là: Cu
Ta có PT:\(\frac{a}{a+1}.\frac{1}{3}=\frac{a}{a+1+4}\)
⇒ a= 1 (g)
%Cu (đồng thau)=11+111+1 .100%= 50%
b)
Trong B:
%Cu=\(\frac{1}{6}\) .100%= 16,67%
%Zn=\(\frac{1}{6}\).100%= 16,67%
%Al= 100%- 2. 16,67%=66,66%
⇒ Để có tỉ lệ như đề bài yêu cầu thì phải :
Tăng mCu lên: x (g)
Tăng mZn lên : y (g)
mAl giữ nguyên
Ta có :
\(\frac{x+1}{x+y+6}.100\%=20\%\)
\(\frac{y+1}{x+y+6}\text{.100%= 50%}\)
⇒ x=\(\frac{5}{3}\) (g) ; y=\(\frac{17}{3}\) (g)